di Barbara Illi1 e Ferdinando Di Cunto2
Istituto di Biologia e Patologia Molecolari, Consiglio Nazionale delle Ricerche (IBPM-CNR), c/o Dipartimento di Biologia e Biotecnologie “Charles Darwin”, Sapienza Università di Roma
2Dipartimento di Neuroscienze “Rita Levi Montalcini”, Università degli Studi di Torino
Indice dei contenuti
Ultimo aggiornamento: 01/02/2021
- Introduzione
- Come nasce un vaccino
- La sperimentazione clinica (trial clinico)
- Vaccini in sviluppo contro il SARS-CoV-2 [agg. 01/02/2021; agg. 23/03/2021]
- I vaccini a RNA [agg. 27/12/2020 e 01/02/2021]
- Conclusioni
“Per i non esperti”
- Plasmide
- Proteina ricombinante
- Elettroporazione
- Lipidi [agg. 27/12/2020]
- Trasfezione [agg. 27/12/2020]
Bibliografia
Introduzione
Poche strategie hanno impedito il propagarsi di epidemie ed evitato migliaia di morti come i vaccini. Ancora oggi, si stanno facendo enormi sforzi per generare vaccini per patologie che ancora non ne hanno uno, come la sindrome da immunodeficienza aquisita (AIDS), la malaria, la tubercolosi. Mentre in alcune regioni del Pianeta, le poche infrastrutture sanitarie e le guerre limitano di molto l’accesso ai vaccini da parte della popolazione, in maniera paradossale, nei Paesi industrializzati, in cui le vaccinazioni sono accessibili a tutti, ormai da qualche anno si assiste ad una certa reticenza nel vaccinare soprattutto i bambini. Questo ha portato alla rinascita di epidemie di patologie da tempo debellate nella stragrande maggioranza dei Paesi, come il morbillo. Basti pensare che in Europa nel 2018 ci sono stati 83 000 casi di morbillo e negli Stati Uniti nei primi 3 mesi del 2019 ci sono stati tanti casi quanti nell’intero 2018. Le ragioni di tanto ostruzionismo risiederebbero in una correlazione tra vaccini e propensione a sviluppare autismo, nonostante diverse pubblicazioni abbiano confermato l’assenza di qualunque base scientifica per tale correlazione1,2.
La COVID-19 rientra nelle malattie altamente contagiose per la quale un vaccino rappresenta, al momento, l’unica via per contrastarla efficacemente. Adoggi, 4 settembre 2020, sono in corso 219 sperimentazioni cliniche che utilizzano vaccini contro la COVID-19 (www.clinicaltrials.gov), a testimonianza dell’impegno profuso dalla comunità scientifica e clinica per trovare una soluzione alla pandemia corrente.
Come nasce un vaccino
La Figura 1 mostra le strategie vigenti per ottenere i vaccini mentre la Tabella 1 elenca le piattaforme potenzialmente usabili e usate per il vaccino contro il SARS-CoV-2 e contro altri agenti patogeni, con indicati vantaggi e svantaggi per ciascuna3.
Piattaforme
- I vaccini a DNA ed RNA sono basati sull’espressione dell’mRNA codificante l’antigene in vivo, dopo l’iniezione di nanoparticelle contenenti l’mRNA (per i vaccini a RNA) o plasmidi (per i vaccini a DNA). Questi vaccini stimolano le risposte immunitarie umorali e cellulari.
- I vaccini basati su proteine ricombinanti hanno il vantaggio di evitare la manipolazione del virus. Richiedono, solitamente, l’aggiunta di adiuvanti per generare una risposta umorale robusta.
- I vaccini basati su vettori adenovirali, sfruttano la capacità di adenovirus geneticamente modificati, ossia deprivati dei geni pericolosi, di indurre una risposta immunitaria innata insieme a una specifica contro l’antigene codificato e incluso nel vettore. Dato che gli adenovirus circolano a frequenza elevata nella popolazione, creano un ambiente immune pre-esistente che riduce l’efficacia dei vaccine basati su vettori adenovirali.
- I vaccini attenuati e quelli inattivati sono prodotti dopo diversi passaggi in coltura (vaccini attenuati), che rendono il virus non più in grado di replicarsi, o dopo inattivazione tramite agenti chimici o calore (vaccini inattivati). I primi sono molto immunogenici e stimolano una risposta immunitaria simile a quella del virus vivo, mentre i secondi sono meno immunogenici e richiedono somministrazioni multiple. È evidente che questi tipi di vaccini, che richiedono anche speciali misure di sicurezza per essere prodotti, non sono facilmente proponibili per la pratica clinica nel caso di virus altamente patogeni.
Figura 1 Strategie per ottenere un vaccino contro SARS-CoV-2.

La figura mostra le diverse strategie e tecnologie con cui, attualmente, si stanno producendo vaccini contro SARS-CoV-2. Abbreviazioni: E, proteina envelope (del rivestimento); S, proteina Spike; M, proteina di membrana; Nm proteina del nucleocapside; RBD, dominio di legame al recettore (Receptor Binding Domain). [Disegno: Barbara Illi]
Tabella 1 Strategie principali per lo sviluppo di vaccini.
| PIATTAFORMA | BERSAGLIO | VACCINI AUTORIZZATI ESISTENTI BASATI SULLA STESSA PIATTAFORMA | VANTAGGI | SVANTAGGI |
| Vaccini a RNA | Spike | No |
|
|
| Vaccini a DNA | Spike | No |
|
|
| Vaccini basati su proteine ricombinanti | Spike | Sì:
|
|
|
| Vaccini basati su vettori virali | Spike | Sì per il VSV (Ervebo)
No per altri vaccini basati su vettori virali |
|
|
| Vaccini attenuati | Virione intero | Sì |
|
|
| Vaccini inattivati | Virione intero | Sì |
|
|
La sperimentazione clinica (trial clinico)
Come tutti i farmaci, anche i vaccini vengono valutati per sicurezza ed efficacia nell’ambito di sperimentazioni cliniche, dette in gergo tecnico trial clinici.
Questo tipo di studi, per essere statisticamente significativi, devono essere randomizzati: ossia, i partecipanti non devono sapere a che gruppo sperimentale (trattato/controllo) sono assegnati. Questi trial possono, poi, essere in cieco, ossia solo i volontari non sanno se stanno ricevendo il farmaco/vaccino o il placebo, o in doppio cieco, in cui nemmeno i ricercatori sanno che cosa stanno somministrando. Quest’ultimo è il trial clinico che più consente di avere dati attendibili, la cui interpretazione non può essere fuorviata neppure dal ricercatore. Infatti, in questo modo, chi riceve il trattamento non può essere positivamente influenzato perché non sa cosa stia ricevendo e, allo stesso tempo, è garantita l’imparzialità del ricercatore nell’osservare i risultati.
I trial clinici possono essere piccoli (con piccoli numeri di pazienti e volontari sani) o grandi, essere effettuati in una sola nazione o essere multicentrici, ossia, coinvolgere più centri di ricerca in nazioni diverse.
Indipendentemente dalla tipologia, ogni trial clinico prevede la stesura di un protocollo clinico che altro non è che il manuale operativo che deve essere seguito, per esempio, nel caso di un trial multicentrico, da tutti i ricercatori appartenenti ai diversi enti che partecipano allo studio. Ciò garantisce l’uniformità necessaria perché i dati possano essere considerati tutti insieme. Ogni protocollo deve essere approvato da un comitato etico, di solito appartenente allo stesso istituto da cui parte la sperimentazione, e, per essere etico, l’applicazione di un protocollo clinico deve essere preceduta dal consenso informato del paziente, se in grado di esprimerlo, o del suo rappresentante legale.
Ogni studio clinico è preceduto da studi pre-clinici in vitro (con cellule in laboratorio) e in vivo, su modelli animali, di solito topi e, per i vaccini, scimmie.
Un trial clonico prevede tre fasi di sperimentazione, più una quarta di farmacosorveglianza, come illustrato nella Tabella 2 sottostante.
Durante ogni fase, le condizioni cliniche e i parametri vitali dei partecipanti vengono strettamente monitorati e registrati. I trial clinici di solito durano anni. Nel caso dei vaccini contro il SARS-CoV-2 c’è stata un’accelerazione impressionante sia degli studi pre-clinici sia di quelli clinici che consentirà, nell’arco di un paio di mesi, di ottenere le prime dosi disponibili.
Tabella 2 Fasi di un trial clinico.
| FASE 1 | FASE 2 | FASE 3 | FASE 4 |
| Volontari sani (da 20 a 80 persone) | Pazienti (da 200 a 300 persone o meno a seconda della patologia) e gruppo controllo | Ampliamento della casistica (fino a 10000 pazienti/volontari) con gruppo controllo | Farmacosorveglianza |
| Determinazione della minima dose efficace e della massima dose tollerata | Scelta delle dosi efficaci e valutazione della sicurezza del trattamento | Prova definitiva della sicurezza ed efficacia del trattamento | Interazioni |
| Valutazione eventi avversi | Farmacoeconomia | ||
| Farmacocinetica | Registri |
Vaccini in sviluppo contro il SARS-CoV-2
Sono molti i vaccini in via di sviluppo contro il SARS-CoV-2. Di seguito sono riportati i più importanti e avanzati a oggi.
- Vaccino ricombinate basato sul vettore adenovirale tipo 5 (Ad5-nCoV) (CanSino Biologicals). Recentemente, i risultati di un trial clinico in aperto, cioè in cui il trattamento era noto, non randomizzato (ClinicalTrials.gov: NCT04313127) hanno mostrato che tutti i 108 volontari selezionati e riceventi questo vaccino non hanno avuto effetti collaterali importanti; sono stati osservati effetti collaterali lievi/moderati e riposte immunitarie sia umorali che mediata da cellule, con un picco a 28 giorni per la risposta umorale e 14 per quella mediata da cellule4.
- INO-4800 (Inovio Pharmaceuticals e Beijing Advaccine Biotechnology). Questo è un vaccino a DNA che prevede l’uso di un elettroporatore (CELLECTRA) per il rilascio intradermico (ClinicalTrials.gov: NCT04336410).
- mRNA-1273 (Moderna). Vaccino a mRNA, incapsulato in una nanoparticella lipidica, codificante la proteina Spike stabilizzata nella sua forma di pre-fusione. Moderna ha pubblicato lo scorso luglio i dati relativi alla sperimentazione su primati. Le scimmie, suddivise in tre gruppi (8 per gruppo), sono state trattate con 10 o 100 μg di vaccino o non sono state trattate. Dopo l’esposizione al virus, sia tramite le vie aeree superiori sia quelle inferiori, in 7 delle 8 scimmie trattate di entrambi i gruppi non sono stati trovati virus in replicazione nel liquido bronco alveolare a due giorni dall’infezione, mentre tutte le scimmie del gruppo ricevente la dose più alta hanno mostrato negatività al virus nelle cavità nasali. Il vaccino ha indotto una risposta anticorpale di tipo neutralizzante con titoli più alti rispetto al plasma convalescente e una parziale risposta mediata da cellule, soprattutto da linfociti CD4+-T helper 1 (Th1). Non è stata invece osservata una risposta cellulare di tipo Th2 o da linfociti T CD8+ (v. anche L’esercito e le armi contro SARS-CoV-2). Gli effetti collaterali si sono rivelati moderati, con un’infiammazione polmonare lieve e scarsa presenza di virus replicante o di antigeni virali5. La sperimentazione sugli esseri umani (ClinicalTrials.gov: NCT04283461) ha visto 45 volontari suddivisi in tre gruppi per tre dosi testate (25–100–250 μg) e due somministrazioni a 28 giorni di distanza l’una dall’altra. I risultati hanno mostrato l’induzione di una risposta anticorpale più forte negli individui trattati con dose alta. Con la seconda somministrazione, il titolo anticorpale è ulteriormente aumentato, in tutti e tre i gruppi, con attività neutralizzante simile a quella del plasma convalescente. Sono stati, però, riscontrati anche effetti collaterali (previsti) leggeri nei gruppi trattati con basse dosi (mal di testa, brividi, mialgia, dolore nel sito dell’infezione), e, in rari casi, avversi, come febbre alta (oltre i 39,5 °C in un individuo del gruppo trattato con la dose più alta) e svenimento6. Tuttavia, nel complesso, il vaccino è stato ben tollerato e ha dato i risultati sperati. La sperimentazione sta procedendo su un maggior numero di individui. [agg. 01/02/2021] Inoltre, molto di recente, è stato osservato che il vaccino di Moderna è efficace nell’indurre anticorpi neutralizzanti anche contro le più recenti varianti, quella individuata inizialmente in Inghilterra B.1.1.7 e quella isolata in Sud Africa, B.1.351, anche se contro quest’ultima è stata dimostrata una minore capacità neutralizzante14. [fine agg.] [agg. 23/3/2021] Questo vaccino si è dimostrato efficace anche nel neutralizzare la variante brasiliana P.1, anche se con efficacia leggermente21. [fine agg.]
- Vaccino Pfizer/BioNTech Questo vaccino, al pari di quello dell’americana Moderna, è un vaccino ad mRNA. Inizialmente, nel corso della fase 1 di sperimentazione, due vaccini “candidati” sono stati assegnati in maniera casuale a 13 gruppi di 15 individui (per un totale di 195 persone) di età compresa tra 18 e 55 anni e tra 65 e 85 anni (in ogni gruppo, 12 persone sono state trattate col vaccino e 3 col placebo). Il vaccino candidato denominato BNT162b1 consiste nell’mRNA che codifica per la forma solubile del dominio di legame al recettore di Spike, mentre quello denominato BNT162b2 codifica una forma dell’intera Spike che si ancora alla membrana. I risultati di questa prima fase (ClinicalTrials.gov number, NCT04368728) hanno mostrato come, a fronte di una sovrapponibile produzione di anticorpi, dopo la seconda dose somministata a 21 giorni di distanza dalla prima, il candidato BNT162b2 dia reazioni secondarie meno severe e per questa ragione si è deciso di proseguire nelle fasi 2 e 3 della sperimentazione clinica solo con il candidato vaccino BNT162b215. Nel corso della fase finale di sperimentazione, la terza, tra le 43 448 persone che hanno ricevuto un’iniezione, 21 720 hanno ricevuto il vaccino, 21 728 il placebo. Le persone sono state assegnate ai gruppi sempre in maniera casuale. A distanza di una settimana dalla seconda dose, solo 8 casi di Covid-19 conclamata sono stati riscontrati nel gruppo trattato col vaccino, contro i 162 del gruppo di controllo, attestando l’efficacia del vaccino al 95%. Inoltre, dopo la prima dose, solo 1 caso di Covid-19 severa è stato rilevato nel gruppo dei vaccinati, contro i 9 casi del gruppo di controllo. Sono state osservate reazioni secondarie sa di lieve entità (stanchezza, mialgia, febbre nel 10-15% dei casi, mal di testa, dolore nel sito di iniezione); quelle di severa entità si sono manifestate in ugual percentuale in ambo i gruppi16.
Molto di recente, anche se su un gruppo piccolo di persone vaccinate, è stato dimostrato che il vaccino BNT162b2 è efficace anche contro la cosiddetta “variante inglese” (B.1.1.7, vedi anche Spillover e pandemia di COVID-19: una prospettiva genomica). Infatti, i sieri raccolti da 20 volontari vaccinati hanno mostrato di neutralizzare anche il virus recante questa mutazione17. [fine agg.] [agg. 23/03/2021] Sebbene con efficacia inferiore rispetto alla capacità neutralizzante sulle varianti D614G e N501Y, questo vaccino è in grado di “riconoscere” anche le varianti sud africana e brasiliana21,22. [fine agg.] - Vaccino di Pittsburgh (PittCoVacc, Università di Pittsburgh). Vaccino contenuto in un cerotto provvisto di 400 microaghi, basato su una subunità di Spike ricombinante. I microaghi sono costituiti di proteine e zuccheri, in modo da dissolversi nella pelle. Questo vaccino origina da uno simile prodotto contro il MERS-CoV e, nei topi, stimola una risposta umorale specifica per l’antigene in due settimane7.
- ChAdOx1 nCoV-19 (Università di Oxford, Advent e Astra Zeneca). Vaccino basato su un vettore adenovirale di scimpanzé che codifica per la proteina Spike. Il ChAdOx1 è derivato dall’isolato adenovirale Y25 ed è stato testato in molti trial clinici e pre-clinici. È sicuro, secondo i dati disponibili, e induce una robusta risposta umorale e mediata da cellule. Dopo i promettenti risultati ottenuti nelle scimmie8, è in corso un trial clinico di fase 3 (ClinicalTrials.gov: NCT04324606). I risultati pubblicati relativi alla fase 1 e 2 hanno riportato sia la produzione di anticorpi sia l’induzione di una risposta mediata da cellule, con scarsi effetti collaterali, mitigati dalla somministrazione preventiva di paracetamolo9,10. [agg. 23/3/2021] Questo vaccino, prodotto dall’azienda farmaceutica AstraZeneca, è attualmente il più utilizzato nel Regno Unito. Si tratta di un caso particolare per alcuni cambiamenti effettuati in corso d’opera sulle modalità di somministrazione. Inizialmente, è stato autorizzato solo per persone tra 18 e 55 anni. Tuttavia, studi ulteriori, anche se su piccoli gruppi, hanno dimostrato un’ottima efficacia anche fino a 79 anni19. Inoltre, è stato aumentato l’intervallo tra una dose e l’altra da 4 a 12 settimane, poiché è stata dimostrata un’efficacia addirittura maggiore con questo intervallo rispetto a quello più breve (81,3% contro il 67%)20. [fine agg.]
- Covid-eVax (Takis Biotech e Rottapharm). Questo è un vaccino a DNA, codificante una porzione di Spike, che richiede l’elettroporazione per la somministrazione intramuscolo. Non sono ancora disponibili risultati pubblicati sulla sperimentazione. Tuttavia, Takis Biotech ha annunciato risultati promettenti in modelli murini in termini di immunogenicità e sicurezza e il passaggio ai test sugli esseri umani in autunno.
- Sono in corso tre trial clinici che fanno uso di vaccini inattivati (ClinicalTrials.gov: NCT04383574; NCT04352608; NCT04412538). Risultati recenti ottenuti con sperimentazioni nelle scimmie, dopo tre immunizzazioni con due dosi del vaccino inattivato (piCoVacc), hanno mostrato protezione contro l’infezione da SARS-CoV-2 e la produzione di anticorpi neutralizzanti anche in modelli murini e di ratto11.
- Sputnik V (Gamaleya Research Institute of Epidemiology and Microbiology; Mosca, Russia). Il cosiddetto vaccino russo è basato anch’esso su vettori adenovirali umani, nella fattispecie gli adenovirus 5 e 26 (Ad5 e Ad26). I risultati non pubblicati di due trial clinici su pochi volontari, i cui dati sono disponibili sul sito www.clinicaltrials.gov e sul sito sputnikvaccine.com, riportano l’insorgenza di una risposta umorale e mediata da cellule. Tuttavia, in assenza di risultati su un numero molto grande di individui non è possibile stabilire né la sicurezza né l’efficacia di questo vaccino, che ha fatto sorgere molti dubbi, soprattutto di carattere etico, all’interno della comunità scientifica. Anche se è vero che un altro vaccino basato sull’Ad5 (vedi punto a) non ha causato eventi avversi su un numero di individui maggiore, questi non possono essere esclusi, compreso il potenziamento dipendente da anticorpi (ADE, Antibody-Dependent Enhancement, v. anche Nel cuore della tempesta), per cui la salute dei cittadini attualmente sottoposti al vaccino andrà costantemente monitorata12,13.
- [agg. 23/3/2021] Il vaccino polisaccaridico coniugato cubano Soberana. Questo vaccino sfrutta una piattaforma molto ben consolidata nella generazione dei vaccini. Sfrutta la capacità immunogenica delle catene di zuccheri (la componente polisaccaridica) che rivestono Spike. In questo vaccino, diverse unità del motivo di legame al recettore glicosilato di Spike sono state coniugate all’anatossina (una tossina resa non più tossica) del tetano, insieme a sali di alluminio come adiuvanti, entrambi per aumentarne l’immunogenicità. I dati preclinici sono molto promettenti23. [fine agg.]
I vaccini a RNA [agg. 27/12/2020]
Nelle nostre cellule, l’informazione genetica è immagazzinata nel DNA ed espressa soprattutto nelle proteine. Per poter diventare proteina, l’informazione viene fotocopiata nel nucleo, cioè nel compartimento cellulare che contiene il DNA; la fotocopia viene quindi trasferita nel citoplasma, dove risiedono i ribosomi, le macchine molecolari che sintetizzano le proteine. Le molecole di mRNA sono le fotocopie dei geni che i ribosomi utilizzano per mettere in fila gli amminoacidi che compongono le proteine. A differenza del DNA, l’mRNA è una molecola molto instabile, che dura nel citoplasma per un massimo di alcune ore, prima di essere distrutto.
Nei coronavirus, le informazioni genetiche non sono scritte nel DNA. Il genoma del SARS-CoV-2 è una molecola di RNA (v. Il mondo sorprendente del genoma di SARS-CoV-2), fatta come una molecola di mRNA. La fusione dell’involucro del virus con la membrana delle cellule fa entrare l’RNA virale nel citoplasma. Qui viene agganciato dai ribosomi e dirige la produzione di molte proteine virali diverse e di nuove molecole di RNA virale. Lo scopo della vaccinazione è indurre la produzione di anticorpi contro la proteina Spike (v. L’infezione alla luce della biologia strutturale) e il reclutamento di linfociti killer, capaci di uccidere le cellule infettate dal virus (v. L’esercito e le armi contro il SARS-CoV-2). La Figura 2 mostra la strategia usata per trasformare le informazioni contenute nel genoma del virus in un vaccino a mRNA.
Figura 2 Strategie per per trasformare le informazioni contenute nel genoma del virus in un vaccino a mRNA.
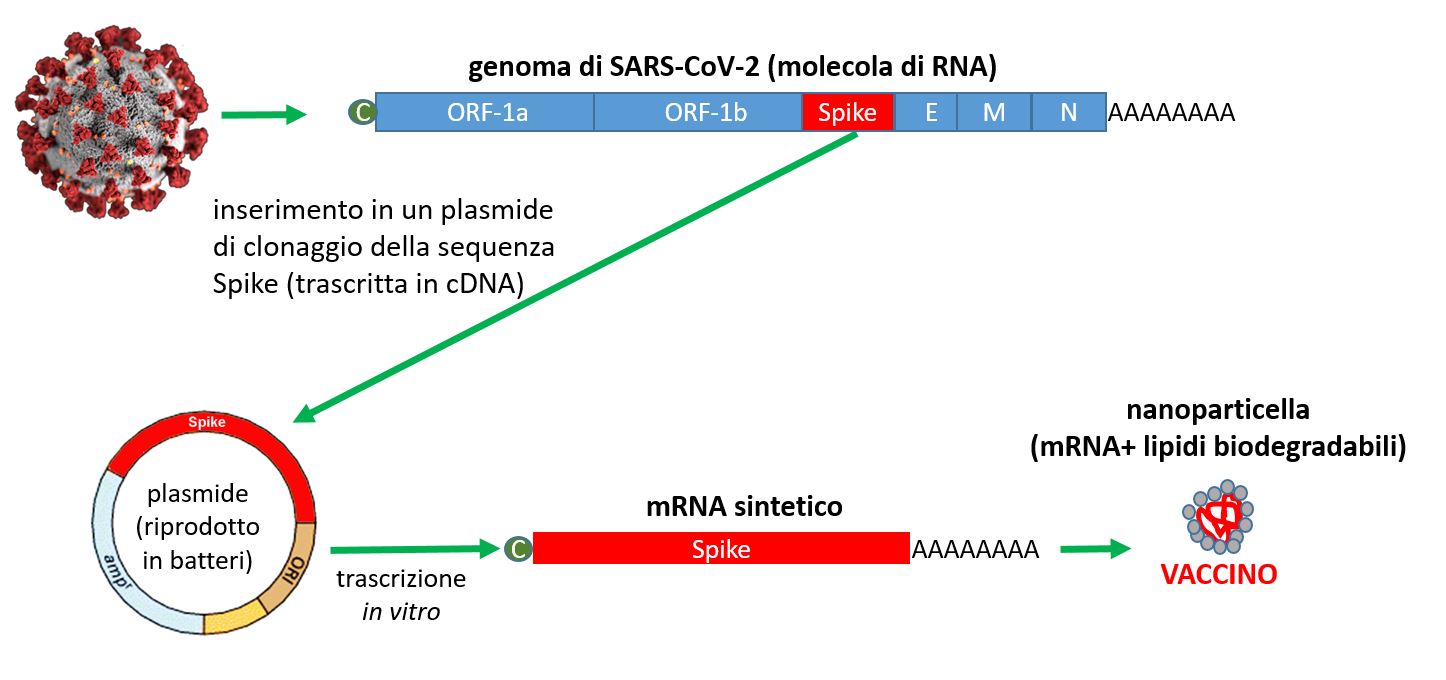
[Disegno: Ferdinando Di Cunto]
Grazie all’ingegneria genetica, le informazioni dell’RNA virale sono state convertite in una molecola di DNA complementare (cDNA) e clonate in una molecola di DNA circolare (plasmide) che viene mantenuta ed espansa solo nei batteri. Il plasmide viene purificato dai batteri e viene usato per produrre in provetta le molecole di mRNA sintetico (Figura 3). L’mRNA non è identico a quello naturale, prodotto dal virus. Oltre a essere solo un piccolo pezzo della sequenza intera, contiene nucleotidi modificati che ne aumentano la tollerabilità e ne migliorano l’efficienza di produzione in proteina. Alla fine della reazione in vitro, il DNA del plasmide viene totalmente distrutto. L’mRNA viene invece purificato e mescolato con lipidi biodegradabili, che formano piccolissime particelle oleose della dimensione di pochi nanometri (nanoparticelle). I lipidi delle nanoparticelle proteggono l’mRNA sintetico dalla degradazione e gli permettono di entrare nelle cellule.
Figura 3 Passaggi principali usati per la produzione del vaccino a RNA.

[Disegno: Ferdinando Di Cunto]
Dopo l’iniezione nel muscolo, le nanoparticelle permettono l’entrata dell’mRNA sintetico (trasfezione) all’interno di diverse cellule nelle vicinanze della sede di iniezione e nei linfonodi che ricevono la linfa drenata da questo sito. L’mRNA viene tradotto in proteina nel citoplasma e viene alla fine degradato senza mai entrare nel nucleo. Le cellule trasfettate esprimono solo la proteina Spike, per qualche ora, al limite per pochi giorni. Oltre a essere esposta in forma intera sulla membrana delle cellule trasfettate, la proteina Spike viene fatta a pezzi e presentata al sistema immunitario, per mezzo degli antigeni di istocompatibilità (HLA, v. L’esercito e le armi contro il SARS-CoV-2), scatenando la risposta anticorpale e cellulare contro questo antigene estraneo.
Principali vantaggi dei vaccini a mRNA rispetto a quelli adenovirali
I vantaggi principali dei vaccini a mRNA rispetto a quelli basati su vettori adenovirali, su cui pure si ripongono molte speranze, sono i seguenti:
- Il fatto che siano costituiti da RNA, che l’mRNA rimanga nel citoplasma e che venga rapidamente degradato garantiscono, al di là di ogni ragionevole dubbio, che questi vaccini non provochino modifiche genetiche. In altre parole, non sono una terapia genica. Infatti, la terapia genica consiste nel sostituire stabilmente un gene difettoso (costituito di DNA non di RNA) con uno che non lo è, o comunque nell’integrare nuovo materiale genetico nel genoma a scopo, ovviamente, terapeutico.
- Nel caso delle piattaforme adenovirali, il problema principale consiste nella produzione di anticorpi contro le proteine dell’adenovirus. Questo problema può rendere inefficaci le eventuali iniezioni di richiamo e l’iniezione di tutti i vaccini successivi sviluppati con la stessa piattaforma. I vaccini a mRNA non dovrebbero presentare questo problema.
- Per la stessa ragione di cui sopra, se dovessero emergere nuovi ceppi virali non neutralizzati dai vaccini approvati (evenienza purtroppo possibile), sarebbe relativamente semplice produrre nuovi vaccini a mRNA in poco tempo. Basterebbe cambiare la sequenza contenuta nelle nanoparticelle.
- La probabilità delle persone vaccinate di sviluppare la Covid-19 è nulla. Il vaccino usa solo una piccola parte dell’informazione del virus, totalmente insufficiente per produrre particelle virali funzionanti.
- La velocità con cui sono stati realizzati non ne compromette l’efficacia e la sicurezza. Sono molte le ragioni per cui questi vaccini sono stati sviluppati a tempo di record. La grande quantità di risorse investite nei progetti di sviluppo dei vaccini anti COVID-19, resa possibile dall’emergenza, ha permesso di accelerare gli studi clinici e di compattarne le tradizionali fasi 1, 2 e 3. Da quello che emerge dai lavori pubblicati, questo finora non ha alterato né la sequenza logica, né la solidità statistica dei risultati ottenuti. La certificazione di tale solidità è data dalla serietà delle agenzie regolatorie (vedi il paragrafo L’autorizzazione per uso di Emergenza più in basso).
Effetti collaterali
Effetti collaterali fastidiosi, di breve durata e non gravi sono decisamente probabili. I dati dello studio di fase 3 di Pfizer/BioNTech, condotto su 43 448 volontari, pubblicati sul New England Journal of Medicine, riportano in più del 50% dei casi mal di testa e stanchezza, febbre nel 10-15% dei casi; è anche molto comune (> 70%) che vi sia dolore e arrossamento nel punto di iniezione. Questi sintomi dipendono dal fatto che il vaccino produce una risposta infiammatoria piuttosto intensa, che quasi sicuramente gioca un ruolo importante nel determinare l’efficacia del vaccino. Questo ha sconsigliato la somministrazione alle persone fortemente allergiche. Nel complesso, le reazioni sono state molto intense in meno dell’1% dei casi e nello studio non sono state osservate morti ascrivibili al vaccino. Per garantire al massimo la sicurezza rispetto a reazioni allergiche gravi, come lo shock anafilattico, è fondamentale che le somministrazioni vengano effettuate in ambienti ben attrezzati per contrastarle, quali in generale sono i centri vaccinali e in particolare i centri allestiti per la somministrazione dei vaccini anti-COVID-19.
Effetti negativi a lungo termine
Al momento non è possibile stabilire se questi vaccini possano dare effetti negativi a lungo termine, ma i dati pubblicati finora e le informazioni dettagliate sulla tecnologia con cui sono stati prodotti possono ragionevolmente far dedurre che le probabilitià siano estremamente remoteprobabilmente non ce ne saranno. I lipidi utilizzati nelle nanoparticelle sono stati scelti anche per la loro biodegradabilità. D’altro canto, i vettori adenovirali sono utilizzati in sperimentazioni cliniche da molti anni. Su questo punto però risposte più solide potranno arrivare solo dopo anni di impiego clinico. Nessun intervento, nessuna tecnologia è del tutto priva di rischi, ma se una tecnologia non viene veramente usata, non è nemmeno possibile conoscere tutti i suoi possibili effetti a lungo termine.
[agg. 01/02/2021] Varianti e vaccini ad RNA
Le varianti virali destano preoccupazione soprattutto poiché potrebbero vanificare l’efficacia dei vaccini, prodotti con enorme impiego di risorse e in pochissimo tempo. I dati raccolti di recente sulla capacità neutralizzante non solo dei vaccini Pfizer/BioNTech e Moderna, ma anche degli anticorpi monoclonali, su cui pure si ripongono grandi speranze, fanno chiarezza su questi importanti argomenti. Le analisi su 20 volontari vaccinati (un numero piccolo) hanno mostrato come l’induzione degli anticorpi e dei linfociti B memoria sia equivalente tra i vaccinati e chi ha superato la malattia. Tuttavia, l’attività contro le varianti E484K o N501Y o la combinazione K417N:E484K:N501Y sembrerebbe ridotta di una frazione piccola ma significativa. Le analisi strutturali della proteina Spike codificata dal vaccino mostrano che essa assume identica conformazione alla proteina Spike codificata dal virus ed è quindi in grado di indurre la stessa risposta anticorpale. Tuttavia 14 su 17 dei più potenti anticorpi monoclonali contro Spike finora individuati mostrerebbero attività ridotta contro le varianti K417N, o E484K, o N501Y. Questi dati suggeriscono l’eventuale necessità di testare gli anticorpi monoclonali contro le nuove varianti isolate e prospettano la possibilità di dover aggiornare i vaccini per evitare perdita di efficacia18. Ovviamente, gli studi andranno ripetuti su un numero maggiore di individui. [fine agg.]
L’autorizzazione per uso di emergenza (EUA, Emergency Use Authorization)
Gli enti che vigilano sulla sicurezza e commercializzazione dei farmaci, e quindi dei vaccini, come la Food and Drug Administration (FDA) per gli Stati Uniti, l’Agenzia Europea del Farmaco (EMA, European Medical Agency) per l’Unione Europea e, a livello nazionale, l’Agenzia Italiana del Farmaco (AIFA), hanno concesso per questi vaccini un’EUA (Emergency Use Authorization, autorizzazione per uso di emergenza). Il criterio principale alla base di un’EUA è accelerare l’impiego di farmaci quando non ci sono alternative per malattie che causino pericolo di vita.
Il secondo criterio è l’efficacia: un farmaco viene approvato per uso emergenziale quando potrebbe essere efficace per prevenire e trattare una malattia, o anche solo per mitigarne la violenza.
Il terzo criterio è il rapporto benefici/rischi: se i risultati delle sperimentazioni dimostrano che i benefici superano i rischi, le agenzie sono disposte a concedere un’EUA.
Il quarto criterio è che non devono esserci valide alternative già approvate per la malattia in questione. Un’EUA è sempre un’eccezione che l’emergenza pandemica ha, necessariamente, richiesto.
Tuttavia la validità dell’operato delle agenzie regolatorie e, quindi, dei prodotti per la salute umana messi in commercio è testimoniata dal Rapporto vaccini per il 2019 dell’AIFA, che ha segnalato soltanto 6757 reazioni avverse su 22 milioni di dosi somministrate, 22 su 100 000 e tra queste solo 2,9 su 100 000 di seria entità. Tutte le reazioni avverse non hanno avuto impatto sul rapporto benefici/rischi dei vaccini. [fine agg.]
Conclusioni
Probabilmente assisteremo all’eliminazione di SARS-CoV-2 solo con la produzione di un vaccino efficace e sicuro, prodotto in larga scala. Tuttavia, il miglioramento delle terapie e, soprattutto, l’adozione di misure di contenimento, hanno fatto diminuire il numero dei contagi e delle morti, almeno in alcuni Paesi. Inoltre, bisogna di nuovo sottolineare che, senza lo sforzo straordinario e la cooperazione tra ricercatori, medici e industrie, gli attuali avanzamenti in termini di terapie e vaccini disponibili non sarebbero stati possibili. Sebbene siamo ancora lontani dal risolvere definitivamente il problema, ora abbiamo più strumenti per affrontare la COVID-19 e sconfiggere il SARS-CoV-2.
“Per i non esperti”
Plasmide
Un plasmide è una molecola di DNA circolare. Il plasmide, una volta inserito in singole cellule o tessuti, produce proteine da geni di interesse che vi sono stati precedentemente inseriti tramite la procedura di clonaggio.
Il clonaggio prevede, di solito, il taglio del gene che interessa da un altro plasmide (si usano proteine chiamate enzimi di restrizione) o la sua moltiplicazione (tramite la tecnica di reazione a catena polimerasica, o PCR, Polymerase Chain Reaction) da plasmide, DNA genomico, RNA messagero (tramite trascrizione inversa). Il gene di interesse così ottenuto viene inserito nel vettore scelto per la sua espressione (cioè, in genere la produzione della proteina corrispondente).
Proteina ricombinante
Una proteina ricombinante è una proteina il cui gene, in genere, è inserito in un plamide per ottenerne la produzione in batteri, lievito o baculovirus (virus degli insetti con DNA a doppio filamento). Di solito, il gene è fuso a una delle due estremità con una piccola sequenza codificante per peptidi, proteine o amminoacidi, che permettono la purificazione della proteina.
Un esempio sono le sequenze composte da più molecole dell’amminoacido istidina, che si legano al nickel, per cui la proteina può essere isolata e purificata in grande quantità se le proteine estratte vengono messe a contatto con colonne di nickel e successivamente lavate. Solo la proteina ricombinante rimane attaccata al nickel. Questa viene di solito poi staccata con specifiche soluzioni.
Elettroporazione
L’elettroporazione è uno dei metodi per inserire molecole di DNA o di altro genere all’interno di cellule singole o tessuti. L’applicazione di una corrente elettrica, tramite appositi dispositivi, a una sospensione cellulare o ad un tessuto produce pori nella membrana cellulare, consentendo alla molecola di entrare.
Lipidi [agg. 27/12/2020]
I lipidi sono stanze insolubili in acqua e nella loro forma più semplice sono costituiti di atomi di carbonio e idrogeno, con una minima quantità di ossigeno. In forma complessa possono presentare molecole diverse, come i carboidrati. Sono i costituenti della membrana cellulare, che circonda tutte le nostre cellule, e delle membrane degli organuli intracellulari, incluso il nucleo.
Trasfezione [agg. 27/12/2020]
La trasfezione è un processo per cui una molecola di acido nucleico, sia essa costituita di DNA o RNA, viene veicolata dall’esterno nelle nostre cellule. Le metodiche possono essere diverse e le principali sono le seguenti:
- la fusione diretta con la membrana cellulare, mettendo a contatto nanoparticelle lipidiche con le cellule;
- l’ elettroporazione, che crea dei buchi sulla membrana grazie a una scarica elettrica, facilitando l’ingresso dell’acido nucleico nelle cellule;
- la nucleofezione, che sfrutta impulsi elettrici e soluzioni saline e l’utilizzo di speciali elettroporatori, nel caso in cui l’acido nucleico debba essere trasportato nel nucleo
- il cosiddetto gene gun (bombardamento con microparticelle), che consiste nell’introdurre nella cellula particelle di oro o tungsteno ricoperte di DNA.
Bibliografia
- Hviid, A., Hansen, J. V., Frisch, M. & Melbye, M. Measles, Mumps, Rubella Vaccination and Autism. Ann Intern Med 171, 388, doi:10.7326/L19-0383 (2019).
- Madsen, K. M. et al. A population-based study of measles, mumps, and rubella vaccination and autism. N Engl J Med 347, 1477-1482, doi:10.1056/NEJMoa021134 (2002).
- Amanat, F. & Krammer, F. SARS-CoV-2 Vaccines: Status Report. Immunity 52, 583-589, doi:10.1016/j.immuni.2020.03.007 (2020).
- Zhu, F. C. et al. Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial. Lancet 395, 1845-1854, doi:10.1016/S0140-6736(20)31208-3 (2020).
- Corbett, K. S. et al. Evaluation of the mRNA-1273 Vaccine against SARS-CoV-2 in Nonhuman Primates. N Engl J Med, doi:10.1056/NEJMoa2024671 (2020).
- Jackson, L. A. et al. An mRNA Vaccine against SARS-CoV-2 – Preliminary Report. N Engl J Med, doi:10.1056/NEJMoa2022483 (2020).
- Kim, E. et al. Microneedle array delivered recombinant coronavirus vaccines: Immunogenicity and rapid translational development. EBioMedicine 55, 102743, doi:10.1016/j.ebiom.2020.102743 (2020).
- van Doremalen, N. et al. ChAdOx1 nCoV-19 vaccine prevents SARS-CoV-2 pneumonia in rhesus macaques. Nature, doi:10.1038/s41586-020-2608-y (2020).
- Sharpe, H. R. et al. The early landscape of COVID-19 vaccine development in the UK and rest of the world. Immunology, doi:10.1111/imm.13222 (2020).
- Folegatti, P. M. et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. Lancet 396, 467-478, doi:10.1016/S0140-6736(20)31604-4 (2020).
- Gao, Q. et al. Rapid development of an inactivated vaccine candidate for SARS-CoV-2. Science, doi:10.1126/science.abc1932 (2020).
- Caddy, S. Russian SARS-CoV-2 vaccine. BMJ 370, m3270, doi:10.1136/bmj.m3270 (2020).
- [agg. 14/09/2020] Logunov, D. Y. et al. Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia. Lancet (2020) doi:10.1016/S0140-6736(20)31866-3.
- [agg. 01/02/2021] Wu K, Werner AP, Moliva JI, Koch M, Choi A, Stewart-Jones GBE, Bennett H, Boyoglu-Barnum S, Shi W, Graham BS, Carfi A, Corbett KS, Seder RA, Edwards DK. Wu K, Werner AP, Moliva JI, Koch M, Choi A, Stewart-Jones GBE, Bennett H, Boyoglu-Barnum S, Shi W, Graham BS, Carfi A, Corbett KS, Seder RA, Edwards DK.bioRxiv. 2021 Jan 25:2021.01.25.427948. bioRxiv. 2021 Jan 25:2021.01.25.427948.
- [agg. 01/02/2021]Walsh EE, Frenck RW Jr, Falsey AR, Kitchin N, Absalon J, Gurtman A, Lockhart S, Neuzil K, Mulligan MJ, Bailey R, Swanson KA, Li P, Koury K, Kalina W, Cooper D, Fontes-Garfias C, Shi PY, Türeci Ö, Tompkins KR, Lyke KE, Raabe V, Dormitzer PR, Jansen KU, Şahin U, Gruber WC. Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates. N Engl J Med. 2020; 383: 2439-2450.
- [agg. 01/02/2021]Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, Perez JL, Pérez Marc G, Moreira ED, Zerbini C, Bailey R, Swanson KA, Roychoudhury S, Koury K, Li P, Kalina WV, Cooper D, Frenck RW Jr, Hammitt LL, Türeci Ö, Nell H, Schaefer A, Ünal S, Tresnan DB, Mather S, Dormitzer PR, Şahin U, Jansen KU, Gruber WC; C4591001 Clinical Trial Group. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine N Engl J Med. 2020; 383: 2603-2615.
- [agg. 01/02/2021]Xie X, Zou J, Fontes-Garfias CR, Xia H, Swanson KA, Cutler M, Cooper D, Menachery VD, Weaver S, Dormitzer PR, Shi PY. Neutralization of N501Y mutant SARS-CoV-2 by BNT162b2 vaccine-elicited sera. Res Sq. 2021 Jan 13:rs.3.rs-143532.
- [agg. 01/02/2021] 18. Zijun Wang, Fabian Schmidt, Yiska Weisblum, Frauke Muecksch, Christopher O Barnes, Shlomo Finkin, Dennis Schaefer-Babajew, Melissa Cipolla, Christian Gaebler, Jenna A Lieberman, Zhi Yang, Morgan E Abernathy, Kathryn E Huey-Tubman, Arlene Hurley, Martina Turroja, Kamille A West, Kristie Gordon, Katrina G Millard, Victor Ramos, Justin Da Silva, Jianliang Xu, Robert A Colbert, Roshni Patel, Juan Dizon, Cecille Unson-O’Brien, Irina Shimeliovich, Anna Gazumyan, Marina Caskey, Pamela J Bjorkman, Rafael Casellas, Theodora Hatziioannou, Paul D Bieniasz, Michel C Nussenzweig. mRNA vaccine-elicited antibodies to SARS-CoV-2 and circulating variants. bioRxiv 2021;2021.01.15.426911.
- [agg. 23/03/2021] Ramasamy, M. N. et al. Safety and immunogenicity of ChAdOx1 nCoV-19 vaccine administered in a prime-boost regimen in young and old adults (COV002): a single-blind, randomised, controlled, phase 2/3 trial. The Lancet 396, 1979–1993 (2020).
- [agg. 23/03/2021] Voysey, M. et al. Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials. The Lancet 397, 881–891 (2021).
- [agg. 23/03/2021] Wang, P. et al. Increased Resistance of SARS-CoV-2 Variant P.1 to Antibody Neutralization. bioRxiv 2021.03.01.433466 (2021) doi:10.1101/2021.03.01.433466.
- [agg. 23/03/2021] Wang, Z. et al. mRNA vaccine-elicited antibodies to SARS-CoV-2 and circulating variants. Nature 1–7 (2021) doi:10.1038/s41586-021-03324-6.
- [agg. 23/03/2021] Valdes-Balbin, Y. et al. SARS-CoV-2 RBD-Tetanus toxoid conjugate vaccine induces a strong neutralizing immunity in preclinical studies. bioRxiv 2021.02.08.430146 (2021) doi:10.1101/2021.02.08.430146.


 Scarica il PDF dell'articolo
Scarica il PDF dell'articolo
Commenti