di Federica Bellerba, Andrea Caldarone, Sara Gandini
Dipartimento di Oncologia Sperimentale, Istituto Europeo di Oncologia (IEO), IRCCS, Milano
Indice dei contenuti
- Introduzione
- Epidemiologia della COVID-19
- COVID-19 e clima
- COVID-19 e inquinamento
- Conclusioni
- Bibliografia
Introduzione
La comprensione delle dinamiche di evoluzione della pandemia di COVID-19 nei prossimi mesi è una questione di grande rilevanza ed urgenza per i governi di tutto il mondo, i quali dovranno prendere decisioni fondamentali sulla base di ciò che è noto sui meccanismi di trasmissione del virus e sulla sua sopravvivenza nell’ambiente.
Il ruolo svolto dai fattori ambientali e dal clima sull’evoluzione dell’epidemia è stato fin dall’inizio oggetto di studio da parte degli esperti, i quali ipotizzavano per il SARS-CoV-2 una stagionalità osservata già in molte malattie infettive e altri ceppi di coronavirus.
Il virus, emerso per la prima volta in Cina a dicembre 2019, si è rapidamente diffuso nell’emisfero settentrionale, muovendosi da est a ovest, in regioni caratterizzate da un clima fresco e temperato tipico della stagione invernale. Mentre queste regioni si avviavano verso la stagione estiva e a una riduzione dei contagi, nell’emisfero australe, che si addentrava nella stagione invernale, si osservava un considerevole aumento dei casi. Tutto questo potrebbe suggerire una suscettibilità climatica del virus e destare preoccupazioni per le prossime stagioni fredde in cui, se ciò fosse confermato, potrebbe verificarsi una nuova ripresa dei contagi.
Epidemiologia della COVID-19
Il 31 dicembre 2019 l’Organizzazione Mondiale della Sanità (OMS) ha dichiarato la presenza di un focolaio di casi di polmoniti con causa ignota nella città di Wuhan, nella provincia cinese di Hubei. Il 9 gennaio 2020 è stato annunciato dalla stessa OMS che le autorità cinesi avevano identificato un nuovo ceppo di coronavirus mai individuato negli esseri umani, che poteva essere la causa di queste polmoniti. Il virus è stato successivamente classificato con il nome di SARS-CoV-2 e la malattia respiratoria da questo causata è stata chiamata COVID-19.
Da quel momento in poi, il virus si è diffuso in tutto l’emisfero, colpendo più di 180 Paesi, tanto che l’11 marzo 2020 l’OMS ha dichiarato l’infezione da nuovo coronavirus SARS-CoV-2 una pandemia. A fine luglio 2020, i casi diagnosticati nel mondo erano più di 16 milioni mentre i decessi registrati erano più di 660 mila. A quella data, i Paesi che hanno registrato il maggior numero dei contagi sono Stati Uniti (oltre 4 milioni), Brasile (oltre 2,4 milioni), India (oltre 1,5 milioni), Russia (oltre 800 mila), Sud Africa (oltre 450 mila), Messico (oltre 400 mila), Perù (oltre 350 mila), Cile (oltre 350 mila), Regno Unito (oltre 300 mila) e Iran (oltre 250 mila), mentre i Paesi con il maggior numero di decessi registrati sono Stati Uniti (oltre 148 mila), Brasile (oltre 88 mila), Regno Unito (oltre 45 mila), Messico (oltre 44 mila), Italia (oltre 35 mila), India (oltre 34 mila), Francia (oltre 30 mila), Spagna (oltre 28 mila), Perù (oltre 18 mila) e Iran (oltre 15 mila) (Figura 1).
L’America è il continente che, attualmente, sta registrando un maggior aumento dei casi, seguita dall’Asia e dall’Africa, mentre l’Europa, fortemente colpita nella prima fase della pandemia durante la stagione primaverile, sta osservando una graduale riduzione dei contagi1.
Figura 1 Casi e morti per COVID divisi per continente dal 31/12/2019 al 28/7/2020.
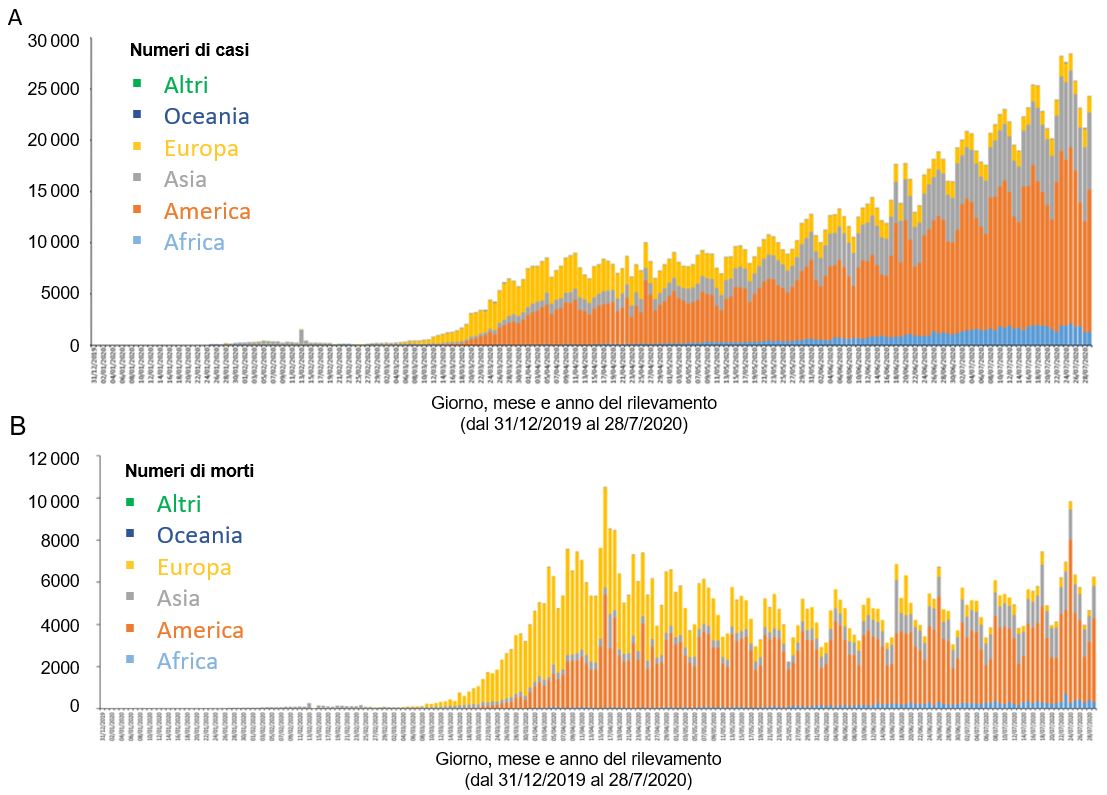
A Distribuzione dei casi di COVID-19 per continente (in base alla definizione di caso e alla strategia di screening adottata da ciascun paese), aggiornata al 30 luglio 2020. B Distribuzione dei decessi COVID-19 per continente, aggiornata al 30 luglio 2020. [Fonte: European Centre for Disease Prevention and Control]
Sintomi
I soggetti affetti da COVID-19 possono riportare diverse tipologie di sintomi, che vanno da forme più leggere a forme più severe. I sintomi più comuni sono febbre, tosse secca e stanchezza, mentre altri sintomi noti sono congestione nasale, mal di testa, congiuntivite, mal di gola, diarrea, perdita di gusto o olfatto e eruzione cutanea o scolorimento delle dita delle mani o dei piedi2. Generalmente, i sintomi si manifestano dai due ai 14 giorni successivi all’esposizione al virus, per questo motivo viene richiesto un periodo di quarantena di 14 giorni per i casi sospetti.
I sintomi possono inizialmente presentarsi in forma lieve per poi intensificarsi nei 5-7 giorni successivi, portando a difficoltà respiratoria o polmonite3. Circa l’80% dei casi guarisce dalla malattia senza ricorrere a cure ospedaliere, mentre 1 persona su 5 affetta da COVID-19 si ammala gravemente e sviluppa difficoltà respiratorie2.
Mortalità
Per conoscere la gravità di questa pandemia è necessario comprendere quale sia il rischio di morire per COVID-19, ossia la probabilità che un soggetto affetto da COVID-19 arrivi alla morte.
Nel corso di questi mesi, si è spesso fatto ricorso a tre diversi rapporti esistenti in letteratura:
- il case fatality rate (CFR);
- il tasso di mortalità;
- l’infection fatality rate (IFR).
Questi rapporti, nonostante siano concettualmente molto diversi, sono stati molte volte utilizzati erroneamente e in maniera intercambiabile:
- il CFR è dato dalla percentuale di persone che muoiono a causa della malattia rispetto al totale dei malati. Il denominatore dipende largamente dal numero reale dei soggetti definiti malati e dalla capacità di screening, per cui non può essere considerato come la probabilità di morire di una persona con COVID-19, in quanto esclude tutto il bacino dei soggetti non testati (solitamente gli asintomatici e pauci-sintomatici, che sono difficili da individuare);
- il tasso di mortalità è dato dal rapporto tra il numero dei decessi registrati e il totale dei soggetti nella popolazione; indica la probabilità che una persona qualsiasi della popolazione muoia per COVID-19. Anche in questo caso, non restituisce la probabilità che una persona contagiata muoia, ma fornisce una misura del rischio di morte a livello di popolazione;
- l’IFR è pari al rapporto tra il numero totale dei decessi e il numero totale dei soggetti entrati in contatto con il virus, inclusi quindi sia i malati sia gli asintomatici; è, quindi, la misura che esprime la probabilità di un soggetto con la COVID-19 di morire. Per poter calcolare questa quantità è necessario conoscere sia il numero reale dei casi che il numero reale dei decessi.
Sulla base di queste definizioni, si parla quindi di letalità plausibile nel caso del CFR, che è misurato sul totale dei casi confermati, e di letalità effettiva per l’IFR che, invece, considera al denominatore tutti i casi, compresi gli asintomatici e i pauci-sintomatici non testati.
Il CFR è la misura che attualmente, a pandemia ancora in corso, viene maggiormente considerata. Viene spesso erroneamente riportato come una quantità unica e costante nel tempo, ma dipende fortemente da diversi fattori come il periodo di riferimento, le caratteristiche della popolazione colpita e, soprattutto, la politica di screening adottata.
Come spiega anche l’Organizzazione Mondiale della Sanità, la reale gravità di una malattia è descritta dal rapporto di mortalità per infezione, l’IFR, che l’OMS stima tra 0,5–1%.
Un Paese che sta affrontando una crescita esponenziale dei contagi avrà probabilmente sia il sistema sanitario sia il sistema di sorveglianza sotto stress, e sarà verosimilmente in grado di testare quasi esclusivamente soggetti ospedalizzati o altamente sintomatici. I casi diagnosticati saranno quindi quelli maggiormente a rischio di morte e ciò comporterà un CFR più elevato. In queste circostanze, il CFR sarà una sovrastima dell’IFR, in quanto non include al denominatore il pool di casi asintomatici e pauci-sintomatici non testati.
Ciò implica che il CFR sarà vicino al valore dell’IFR solo quando le campagne di screening includeranno la popolazione asintomatica, ma questa strategia è molto complessa da implementare. Nella valutazione di queste stime bisogna per altro tenere in conto anche delle basse performance dei test soprattutto nel caso degli asintomatici.
Allo stesso tempo, il CFR è una misura che dipende dal numero dei decessi registrati. Essendo la pandemia ancora in corso, è probabile che alcuni individui che sono attualmente malati di COVID-19 nel futuro moriranno di questa malattia. Questo significa che il numeratore attuale del CFR è una sottostima degli effettivi decessi che si registreranno tra i casi attualmente confermati, in quanto alcuni casi di oggi non sono ancora arrivati alla morte ma lo faranno. È inoltre inverosimile che tutti i decessi da COVID-19 vengano accertati tramite il test, quindi questa è un’ulteriore fonte di bias che porta il CFR a sottostimare l’IFR. Un esempio è ciò che è avvenuto durante l’epidemia di SARS-CoV del 2003, in cui il CFR nelle prime fasi dell’epidemia era pari al 3-5%, per poi arrivare a circa il 10% a fine epidemia4,5.
Solo a fine pandemia, quindi, sarà possibile avere una stima realistica dell’effettivo CFR. Per questo motivo, bisogna mostrare cautela nell’interpretazione dei CFR attuali.
Al momento, i CFR variano ampiamente da Paese a Paese e vanno dallo 0,1% di Singapore al 27,9% dello Yemen6. Una meta-analisi condotta dal Centre for Evidence-Based Medicine dell’Università di Oxford, aggiornata al 26 maggio 2020, ha riportato un’eterogeneità molto alta tra i CFR dei vari Paesi, pari al 100%7.
L’età della popolazione testata e diagnosticata potrebbe avere un ruolo importante nello spiegare questa grande differenza tra Paesi. È noto, infatti, che il valore del CFR aumenta con l’età, per questo motivo la distribuzione dell’età di una popolazione potrebbe influenzare in maniera significativa il valore complessivo del suo CFR. Un esempio è dato dall’Italia, la quale presenta una letalità apparente molto alta se confrontata con quella di molte altre nazioni ma, allo stesso tempo, ha la popolazione più longeva al mondo dopo il Giappone. L’età potrebbe, quindi, essere uno dei fattori chiave per spiegare questa anomalia. In merito a questo, per nove Paesi che hanno reso noti i CFR per fascia di età (Italia, Olanda, Spagna, Francia, Cina, Svizzera, Corea del Sud, Stati Uniti e Germania) sono stati trasformati i CFR complessivi in CFR standardizzati secondo la distribuzione dell’età della popolazione (Age-expected CFR) e rispetto a una distribuzione standard dell’età che permettesse il confronto tra Paesi (Age-standardized CFR), sotto l’ipotesi che tutte le fasce d’età abbiano la stessa probabilità di essere contagiate. Questo ha ridotto di molto le differenze tra le nazioni: per esempio, i CFR dell’Italia e della Spagna sono dimezzati passando, rispettivamente, da 9,2 a 4,6 e da 6,0 a 2,9, il CFR dell’Olanda è diminuito di quasi due terzi passando da 7,4 a 2,6 mentre il CFR della Germania è salito 0,7 a 1,5 (Figura 2). Questi risultati suggeriscono, quindi, che le stime delle letalità sono distorte dall’età degli individui testati e, per questo motivo, dipendono fortemente dalle strategie di screening adottate da ciascun Paese8.
Figura 2 Distribuzione in base all’età attesa e standardizzata.
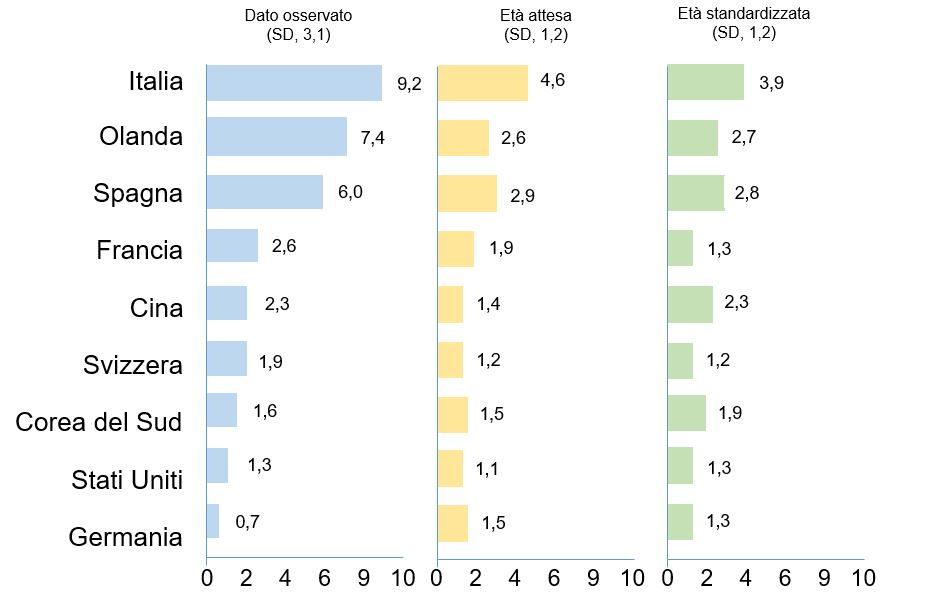
Nel grafico a sinistra è rappresentato il case-fatality rate della COVID-19 osservato in ciascun Paese; nel grafico in centro è rappresentato l’age-expected case-fatality rate nei vari Paesi, ossia il case-fatality rate della COVID-19 costruito tenendo conto della distribuzione dell’età della popolazione di ciascun Paese; nel grafico a destra è rappresentato l’age-standardized case fatality rate, ossia il case fataliy rate della COVID-19 costruito prendendo in considerazione una distribuzione standard dell’età della popolazione, ottenuta dalla distribuzione dell’età media osservata tra tutti i casi dei nove Paesi. [Basato su: Sudharsanan N, Didzun O, Bärnighausen T, Geldsetzer P. The Contribution of the Age Distribution of Cases to COVID-19 Case Fatality Across Countries: A 9-Country Demographic Study. Ann Intern Med. 2020 Jul 22;M20-2973.]
Di conseguenza, fare affidamento alle stime di CFR potrebbe non fornire una misura accurata della gravità della malattia e del rischio di morire per COVID-19. Malgrado questo, rimane un indicatore molto importante, in quanto la sua variabilità temporale e le differenze geografiche possono aiutare a comprendere sia il momento della pandemia in cui si trova ciascun Paese sia la politica di screening adottata6.
A differenza del CFR e dell’IFR, il tasso di mortalità è un indicatore epidemiologico molto solido in quanto, essendo misurato a livello di popolazione, permette di effettuare confronti nel tempo e a livello territoriale. Attraverso questi confronti fornisce, quindi, informazioni molto utili sia sullo stato di salute generale della popolazione sia sui meccanismi di diffusione di una determinata malattia, come, per esempio, la COVID-199.
In Italia, durante la pandemia, ci sono stati circa 40mila morti in più rispetto a quelli attesi negli anni precedenti10. Malgrado questo, aumenti simili sono stati osservati anche nel passato: nel 2015, per esempio, sono state registrate 50mila morti in più rispetto all’anno precedente a causa del picco influenzale della stagione invernale e delle ondate di calore registrate nella stagione estiva11.
Per avere una comprensione più chiara di come la COVID-19 abbia influito in termini di mortalità sulla popolazione è quindi necessario approfondire che cosa è successo a livello territoriale. Confrontando i dati della mortalità tra gennaio e maggio 2020 a livello regionale con quelli dello stesso periodo del 2015 emerge come, in realtà, la pandemia abbia colpito in maniera drammatica prevalentemente le regioni del nord, in particolar modo la Lombardia, mentre ha avuto un effetto molto più contenuto nelle regioni del centro-sud. Questo implica che nelle province più duramente colpite dal virus, come Brescia, Cremona e Bergamo, nei prossimi anni ci sarà un forte ridimensionamento dell’aspettativa di vita, mentre ci si attendono conseguenze molto meno significative per il resto del territorio nazionale (Figura 3).
Figura 3 Distribuzione dei decessi giornalieri dal 1 gennaio al 31 maggio del 2015 e del 2020 in quattro regioni italiane: Lombardia, Lazio, Campania, Sicilia.
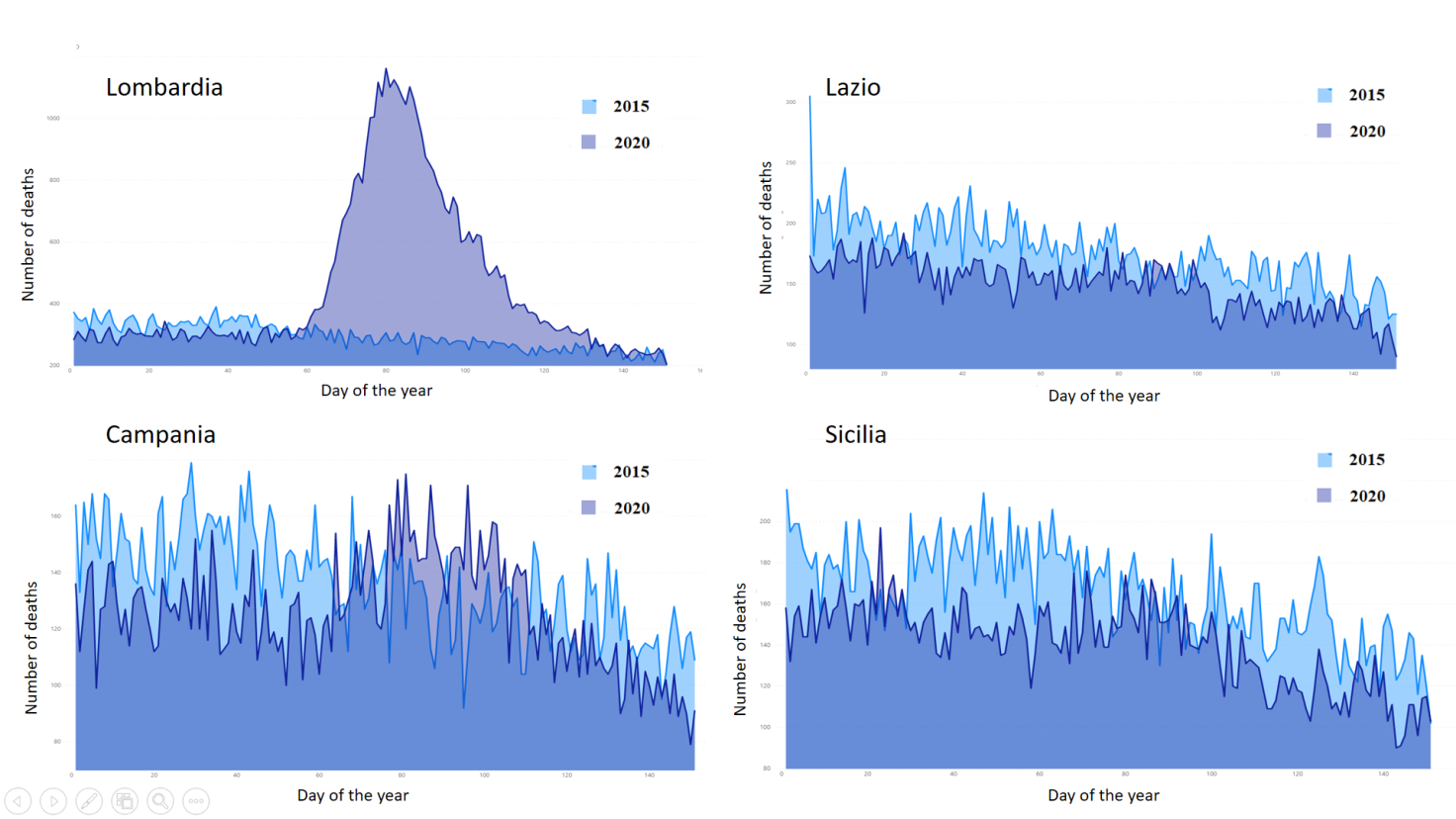
I dati provengono dall’Istat, la quale ha diffuso i dati sui decessi per 7.357 comuni (su un totale di 7.904, il 93,1%). [Fonte: Istat. Dati di mortalità: cosa produce l’ Istat. Decessi anni 2015-2020.]
Comorbidità nei deceduti con COVID-19
Le persone anziane e con patologie concomitanti come ipertensione, problemi cardiaci e polmonari, diabete o cancro, sono a maggior rischio di sviluppare una forma grave di malattia2. In Italia, l’età mediana dell’infezione è di 61 anni mentre l’età mediana dei pazienti deceduti è di 81anni (85 anni per le donne e 79 anni per gli uomini). Il numero mediano di patologie concomitanti nei pazienti deceduti è pari a 3 (Figura 4); di queste, le più frequenti sono l’ipertensione arteriosa (66,2%), il diabete mellito di tipo 2 (29,8%), la cardiopatia ischemica (27,7%) e la fibrillazione arteriale (23%). I sintomi più ricorrenti nei pazienti deceduti sono, invece, la febbre, la dispnea e la tosse, mentre sono meno frequenti diarrea ed emottisi12.
Figura 4 Distribuzione del numero di patologie concomitanti nei pazienti positivi all’infezione SARS-CoV-2 e deceduti in Italia.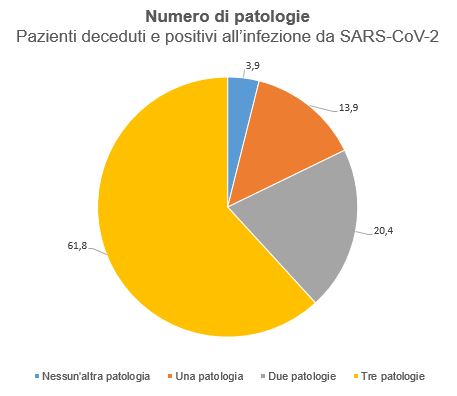
Il ruolo del sesso nella COVID-19
Anche il sesso sembra giocare un ruolo molto importante in questa pandemia, in particolare per quanto riguarda la letalità, ossia la percentuale di decessi registrati sul totale dei casi COVID-19 confermati. Secondo il bollettino della sorveglianza integrata COVID-19, aggiornato al 14 luglio 2020 e pubblicato dall’Istituto Superiore di Sanità, in Italia la letalità maschile da COVID-19 è più alta di quella femminile in tutte le fasce d’età, a eccezione della fascia 0–9 anni, con una letalità complessiva maschile del 17,6% e femminile del 10,9%13.
Lo stesso andamento è stato osservato anche in molti degli altri Paesi europei ed extra-europei che hanno pubblicato i dati disaggregati per sesso (a eccezione delle Maldive, del Nepal, della Slovenia, della Finlandia, della Costa Rica e di Israele)14 ed è stato confermato in uno studio inglese condotto su oltre 17 milioni di pazienti anche dopo aver aggiustato l’analisi per età e diversi malattie concomitanti15 (Hazard Ratio maschi vs femmine: 1.59; 95% CI: 1,53, 1,65; Figura 5).
Figura 5 Case fatality rate negli uomini e nelle donne.
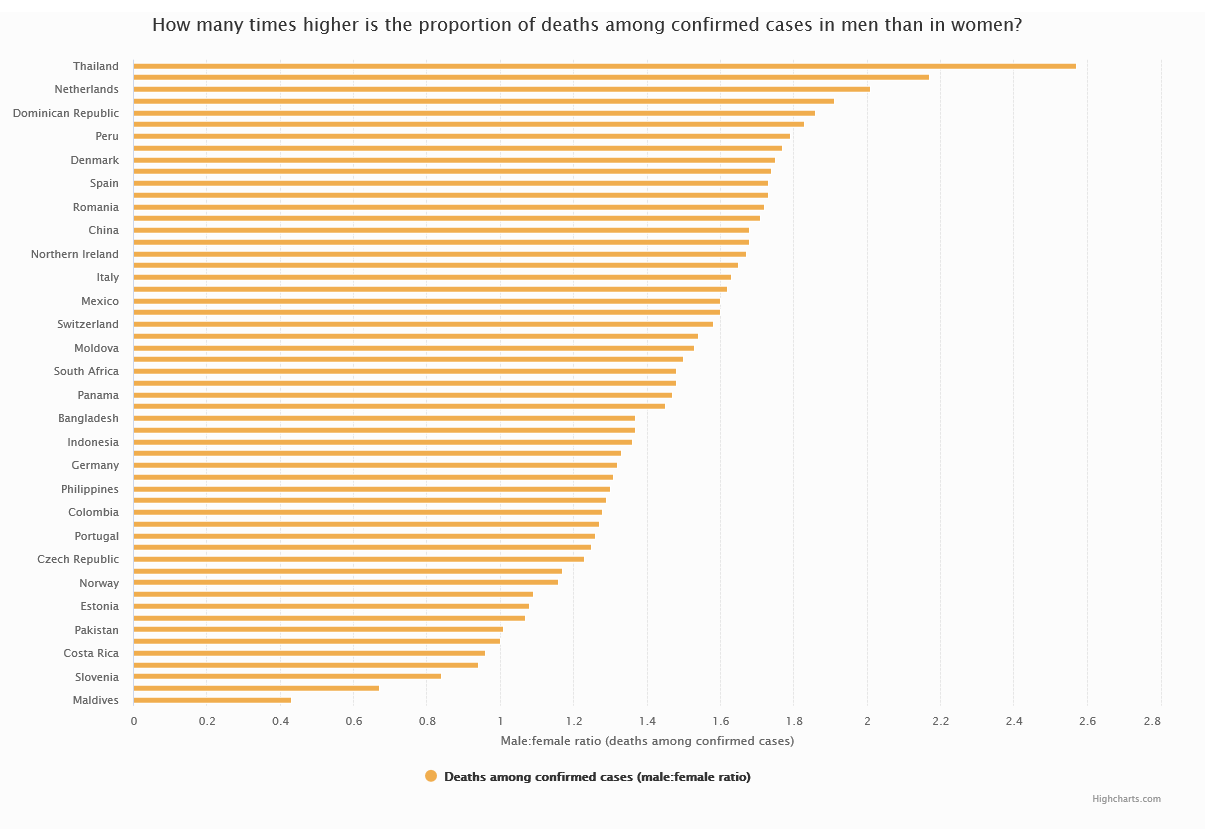
Nel grafico sono rappresentati i rapporti tra il case-fatality rate della COVID-19 osservato negli uomini e quello osservato nelle donne, per tutti i Paesi che hanno reso disponibili i dati disaggregati per sesso. I dati sono aggiornati al 24 luglio 2020. [Fonte: COVID-19 sex-disaggregated data tracker, Global Health 5050.]
Risulta, invece, meno chiaro se ci sia un possibile ruolo del sesso nella diffusione del contagio. In Italia, infatti, la percentuale di donne contagiate sul totale dei casi registrati è del 54,1%, in maniera simile a molti degli altri stati europei, mentre nei Paesi africani, asiatici e sudamericani si osserva, tra i casi registrati, una prevalenza maggiore di maschi14. Questi dati sono probabilmente influenzati dal numero di test diagnostici effettuati nei due gruppi e dalle caratteristiche demografiche delle popolazioni.
Un altro dato rilevante riguarda il numero di contagi tra gli operatori sanitari. In Italia, questi corrispondono al 12,2% dei casi totali, hanno un’età mediana di 48 anni e nel 72,2% dei casi sono donne13. Questa percentuale è simile a quella riportata da altri Paesi come la Spagna (77%), gli Stati Uniti (73%), la Germania (73%) e la Repubblica Dominicana (64%)16 e potrebbe essere giustificata dal fatto che, in questa categoria professionale, ci sia una più alta percentuale di donne. Nonostante ciò, questi risultati sottolineano anche l’importanza della fornitura dei dispositivi di protezione a queste figure professionali17.
COVID-19 e clima
La maggior parte dei virus respiratori, tra cui l’influenza, mostra una tendenza stagionale all’infezione, con picchi di incidenza durante la stagione invernale e una trasmissione spazio-temporale fortemente associata a fattori metereologici, come temperatura e umidità atmosferica18,19.
Nel 2010 sono stati individuati tre tipi di coronavirus (HCoV-HKU1, HCoV-NL63 e HCoV-OC43) che presentavano una significativa stagionalità invernale, con una diffusione dell’infezione avvenuta principalmente tra dicembre e aprile, in maniera molto simile al modello influenzale20. Anche l’epidemia di SARS-CoV, diffusasi in Cina nel 2013, ha raggiunto il picco di incidenza durante la stagione primaverile, ma il suo rapido contenimento non ha permesso di approfondire l’effetto della stagionalità sulla diffusione. Al contrario, il picco di diffusione della MERS-CoV è avvenuto durante la stagione estiva e principalmente in un Paese a clima caldo come l’Arabia Saudita21,22. In quella circostanza, alte temperature e bassa umidità sono risultate associate a una maggiore incidenza dei casi23.
Data la variabilità delle evidenze sulla suscettibilità dei coronavirus ai fattori climatici e data la limitatezza dei dati disponibili sulla COVID-19, risulta, quindi, complesso comprendere e fare previsioni sull’evoluzione della pandemia con l’alternarsi dei prossimi cicli stagionali.
Alcuni studi di laboratorio, condotti sotto condizioni controllate, hanno rilevato una sensibilità del virus SARS-Cov-2 alle alte temperature. In particolare, è stata osservata:
- una riduzione di 0,7 log-unità dopo 14 giorni di incubazione a una temperatura di 4 °C (concentrazione finale ~ 6,8 log-unità del 50% della dose infettante di coltura tissutale, TCID50, per mL);
- una riduzione di oltre 3 log-unità dopo 7 giorni di incubazione a 22 °C e nessuna rilevazione del virus dopo 14 giorni;
- una riduzione di oltre 3 log-unità a 37 °C dopo un solo giorno e nessuna rilevazione del virus nei giorni successivi.
Considerando temperature molto elevate, invece, non è stato più rilevato il virus dopo 30 minuti a 56 °C o dopo 5 minuti a 70 °C24.
Anche molti studi epidemiologici hanno investigato il ruolo della temperatura e degli altri fattori climatici sulla diffusione del virus, portando a risultati contrastanti. I primi studi basati sui dati provenienti dalla Cina hanno mostrato una relazione inversa tra la temperatura e l’umidità atmosferica e la diffusione del virus. In particolare, uno studio condotto considerando i casi provenienti da 30 regioni della Cina tra dicembre 2019 e febbraio 2020 ha osservato una riduzione dal 36% al 57% dei casi giornalieri di COVID-19 all’aumentare di 1 ° C della temperatura media giornaliera, in un range di umidità relativa compreso tra il 67% e l’87%, e una riduzione dall’11% al 22% di casi giornalieri all’aumentare di 1% di umidità relativa, all’interno di un intervallo di temperatura media giornaliera tra 5 °C e 8.2 °C. Nonostante ciò, queste associazioni non sono risultate riproducibili per tutta la Cina continentale25. Risultati simili sono stati osservati anche per il tasso di contagiosità Rt, con l’aumento della temperatura e dell’umidità relativa significativamente associati a una riduzione del tasso di trasmissione, sia prima sia dopo l’attuazione delle misure di lockdown26.
A partire da febbraio 2020, poi, la diffusione del virus ha iniziato a muoversi al di fuori della Cina, per arrivare in diverse regioni del mondo.
Subito dopo la Cina, l’Italia è stato il Paese più colpito dalla pandemia. Anche in questo caso si è ipotizzato un legame tra fattori climatici e la diffusione del virus, dato che le regioni del nord come la Lombardia, il Veneto e l’Emilia Romagna sono state colpite molto più duramente rispetto alle regioni del centro e del sud del Paese. Uno studio condotto dal Prof. Scafetta dell’Università Federico II di Napoli ha osservato che il clima invernale che ha caratterizzato la città di Wuhan nel 2020 è stato molto simile a quello osservato tra febbraio e marzo 2020 a Milano, Bergamo e Brescia, che sono state le province italiane colpite con più forza dalla COVID-1927. Diversi studi hanno, inoltre, cercato di individuare intervalli specifici di temperatura e di umidità favorevoli alla diffusione del virus. È stato osservato che, tra gennaio e marzo 2020, c’è stata una crescita più elevata dei casi nelle regioni temperate dell’emisfero del Nord e una diffusione più contenuta nelle regioni più calde ed umide o più fredde e secche28. In particolare, il virus si è diffuso maggiormente all’interno del corridoio di 30–50 °N, in regioni con temperature medie di 5–11 °C, combinate con bassa umidità specifica (3–6 g/kg) e con bassa umidità assoluta (4–7 g/m3)29.
Uno studio condotto considerando il numero dei casi e dei decessi registrati in 166 Paesi nel mondo (esclusa la Cina) fino al 27 marzo 2020 ha osservato che la temperatura e l’umidità relativa erano inversamente associate sia con il numero di nuovi casi giornalieri sia con il numero di decessi giornalieri. L’analisi ha tenuto conto di possibili fattori di confondimento, tra cui la velocità del vento, l’età mediana della popolazione, il Global Health Security Index, l’Indice dello sviluppo umano e la densità di popolazione. In particolare, gli autori hanno osservato che l’aumento di 1°C era associato ad una riduzione del 3,1% (95% CI: 1,5%, 4,6%) dei nuovi casi giornalieri e dell’1,2% (95% CI: 0,44%, 2,0%) dei nuovi decessi giornalieri, mentre un aumento dell’1% di umidità relativa era associato a una riduzione dello 0,9% (95% CI: 0,5%, 1,2%) dei nuovi casi giornalieri e dello 0,5% (95% CI: 0,34%, 0,67%) dei nuovi decessi giornalieri30. Risultati simili sono stati riportati anche da un altro lavoro, condotto sul numero di casi confermati fino al 12 marzo 2020 in 310 regioni di 116 paesi nel mondo: in questo caso, l’incidenza della COVID-19 è risultata inversamente associata non solo alla temperatura e all’umidità relativa, ma anche alla velocità del vento e all’indice UV riferito a due settimane precedenti l’incidenza, ossia prima del periodo di incubazione del virus31.
Contrariamente a queste evidenze, però, ci sono anche lavori più recenti che non hanno trovato alcun legame significativo tra clima e diffusione del virus o che hanno riportato un legame debole o non riproducibile per tutte le regioni geografiche. Secondo uno studio non ancora sottoposto a revisione paritaria e condotto sui casi registrati nel mondo tra il 31 dicembre 2019 e il 15 aprile 2020, non c’è in realtà evidenza di un legame tra la temperatura e la trasmissione del virus. Lo studio, che ha incluso anche i casi registrati in alcuni tra i Paesi che si sono affacciati più di recente alla pandemia, come il Brasile, suggerisce che le associazioni osservate negli studi precedenti potrebbero essere distorte dal fatto che, inizialmente, il virus si sia diffuso principalmente nelle zone temperate del nord dell’emisfero, che sono anche quelle caratterizzate da una maggiore mobilità umana32.
Uno studio dell’Università di Toronto ha analizzato l’effetto dei fattori climatici sul numero di casi confermati tra il 20 marzo 2020 e il 27 marzo 2020 in 144 Paesi. Nell’analisi multivariata, che ha preso in considerazione diversi confondenti socio-demografici e informazioni sugli interventi di sanità pubblica, hanno osservato che la temperatura, la latitudine e l’umidità assoluta non erano associate a un aumento della diffusione del virus33.
Un recente lavoro condotto in collaborazione tra più enti di ricerca e non ancora sottoposto a revisione paritaria ha, invece, valutato come la temperatura, l’umidità, l’esposizione ai raggi ultravioletti ed altri fattori climatici abbiano influenzato il tasso di contagiosità del virus Rt in quasi 4000 località nel mondo. Nonostante l’alta temperatura e una maggiore esposizione ai raggi ultravioletti siano risultati avere un modesto effetto sulla diffusione del SARS-CoV-2, lo studio conclude che questi non sono sufficienti a controllare l’evoluzione della pandemia34.
Dello stesso parere è la National Academies of Sciences, Engineering and Medicine, la quale, attraverso una revisione rapida della letteratura pubblicata e non pubblicata, invita alla cautela nell’interpretazione di questi lavori35.
Tutti gli studi che hanno affrontato il discorso sulla stagionalità del virus hanno, infatti, diversi limiti e sono fortemente influenzati sia dalla breve finestra temporale a cui i dati fanno riferimento sia dal fatto che la prima fase dell’epidemia, partita dalla Cina, si sia limitata alle regioni settentrionali dell’emisfero. Anche la qualità dei dati e i diversi criteri di classificazione e comunicazione dei casi COVID-19 adottati dai vari Paesi possono avere influito sui risultati.
Ci sono, inoltre, diversi fattori di confondimento legati al territorio (e, quindi, alla temperatura e al clima) che potrebbero, in realtà, meglio spiegare la trasmissione del virus e che sono, però, molto complessi da misurare e controllare all’interno di studi epidemiologici. Tra questi, ci sono la tipologia del sistema sanitario, le misure di contenimento adottate, la possibilità di accesso alle cure, le abitudini comportamentali, i flussi di spostamento all’interno e all’esterno del territorio nazionale e il blocco dei voli aerei. In merito a questo, alcuni studi hanno osservato che il trasporto aereo ha contribuito alla diffusione del virus36,37, anche nel caso di screening dei viaggiatori38, mentre le pratiche di limitazione dei viaggi applicate da molti Paesi hanno permesso di rallentare la propagazione del virus39,40.
Limitarsi, quindi, allo studio esclusivo delle variazioni dei fattori climatici potrebbe non restituire una fotografia rappresentativa della realtà e affidarsi all’arrivo della stagione calda e all’innalzamento delle temperature senza la programmazione e l’attuazione di politiche sanitarie mirate potrebbe non essere sufficiente per il contenimento del virus41,42.
Nonostante ci siano evidenze che suggeriscono una potenziale riduzione dei casi nei periodi più caldi e umidi, bisogna essere consapevoli che questi risultati non sono sufficienti a stabilire un legame di causalità. Attualmente, stiamo assistendo ad una rapida diffusione del virus nelle zone dell’emisfero australe e in Paesi caldi e in pieno clima estivo, come l’India, l’Iran e diversi stati degli Stati Uniti, quindi i dati provenienti da questi Paesi saranno fondamentali per comprendere meglio l’influenza dei fattori climatici sulla trasmissione del SARS-CoV-2.
COVID-19 e inquinamento
Il legame tra inquinamento e COVID-19 è un argomento attualmente molto dibattuto nella comunità scientifica, dato che alcune tra le aree maggiormente colpite dalla pandemia, come la regione cinese di Hubei, la Pianura Padana e la città di New York, sono, allo stesso tempo, regioni caratterizzate da alti livelli di inquinamento atmosferico. Questo ha portato gli esperti a domandarsi se ci sia un legame di causa-effetto tra l’inquinamento e la COVID-19 sia nella diffusione del virus sianella prognosi delle patologie legate all’infezione da virus SARS-CoV-2.
Un articolo presentato dalla Società Italiana di Medicina Ambientale (SIMA) a metà marzo ha ipotizzato che il particolato atmosferico PM10 possa avere un ruolo di trasportatore veicolante del virus (carrier) sia in maniera diretta sia attraverso un’azione di boost, ossia di impulso alla diffusione. Queste conclusioni sono state tratte dopo aver osservato una forte correlazione tra il numero di casi di COVID-19 registrati nelle province italiane aggiornati al 3 marzo 2020 e il numero di superamenti del limite consentito dalla legge delle concentrazioni di PM10 nel periodo tra il 10 febbraio e il 29 febbraio43.
Un secondo studio del SISMA ha, inoltre, individuato tracce di RNA del virus in diversi campioni di PM10 raccolti in siti industriali della provincia di Bergamo tra il 21 febbraio e il 13 marzo, portando gli autori a ipotizzare una possibile trasmissione aerea del virus attraverso il particolato44. Queste posizioni, che hanno avuto un forte risalto mediatico, hanno portato diverse istituzioni45,46 e ricercatori47 a manifestare dubbi sulla metodologia utilizzata e a invitare alla cautela nell’interpretazione di questi risultati. Nonostante, infatti, sia nota da tempo la presenza di particelle biologiche come batteri, funghi e virus nel particolato atmosferico48, non esistono prove sperimentali in grado di dimostrare che i coronavirus siano capaci di mantenere una carica virale infettiva per un tempo prolungato in un ambiente esterno49. Per questo motivo, sulla base delle conoscenze attuali, la maggior parte degli esperti tende a non credere plausibile che il particolato atmosferico possa svolgere un ruolo di “trasportatore” del virus.
Nonostante questo, è ormai noto che l’esposizione ad alte concentrazioni di particolato atmosferico e NO2 sia correlata a una maggiore prevalenza di malattie respiratorie e cardiovascolari, con una conseguente maggiore suscettibilità a infezioni respiratorie e una maggiore severità nella manifestazione dei sintomi48.
Secondo l’Organizzazione Mondiale della Sanità, l’inquinamento atmosferico provoca ogni anno circa 4,2 milioni di morti premature. Nel 2016, il 58% di queste morti sono state dovute a cardiopatia ischemica e ictus, il 18% a patologie polmonari ostruttive croniche e infezioni acute delle basse vie respiratorie, mentre il 6% al cancro al polmone50.
Sulla base di queste informazioni, una delle domande a cui gli esperti stanno cercando di trovare una risposta è se l’esposizione all’inquinamento atmosferico possa portare a sviluppare una forma più severa di infezione da SARS-CoV-2 e, di conseguenza, a un maggior rischio di morte.
L’ipotesi è che l’esposizione cronica al particolato atmosferico possa attivare un processo di infiammazione e condurre all’insorgenza di sintomi più gravi. Diversi studi, infatti, hanno mostrato che sia il PM2,5 sia il PM10 causano nell’uomo un’infiammazione sistemica con una sovraespressione di diverse citochine, tra cui IL8, IL17, IL6, TNFα. Queste alterazioni, oltre a contribuire all’insorgenza di patologie cardiorespiratorie, comportano un indebolimento del sistema immunitario, il quale potrebbe condurre a una sindrome da distress respiratorio acuto o, nella peggiore delle ipotesi, alla morte51.
Anche alcuni studi epidemiologici hanno investigato la possibile associazione tra inquinamento atmosferico e mortalità per COVID-19.
Una particolare attenzione mediatica è stata rivolta a uno studio non ancora revisionato dell’università di Harvard, il quale ha approfondito il legame tra esposizione a lungo termine al PM2,5 e il tasso di mortalità per COVID-19. L’analisi è stata svolta considerando circa 3000 contee degli Stati Uniti (pari al 98% della copertura totale del territorio) e pubblicata in due versioni. Nella prima versione, è stata condotta un’analisi multivariata basata sul numero di decessi da COVID-19 registrati nelle contee statunitensi fino al 4 aprile 2020, in cui si è tenuto conto di diversi confondenti legati a fattori sociodemografici (come densità di popolazione, percentuale di ultra sessantacinquenni, percentuale di poveri, etnia, reddito ed altre) e alle condizioni climatiche (temperatura media invernale, temperatura media estiva, umidità relativa media invernale, umidità relativa media estiva). I risultati di questa prima analisi hanno mostrato che l’incremento di 1 µg/m3 di PM2,5 era associato a un aumento del rischio di mortalità per COVID-19 pari al 15% (95% CI: 5%, 25%).
Successivamente, nella seconda versione, le analisi sono state aggiornate con i decessi registrati fino al 22 aprile 2020 e sono stati aggiunti ulteriori confondenti riguardanti i tempi di diffusione del virus e di attuazione delle politiche di distanziamento sociale nelle varie contee, e un maggior dettaglio sulla distribuzione per età della popolazione. L’aggiunta di queste ulteriori informazioni ha ridotto in modo considerevole la forza dell’associazione tra il particolato atmosferico e la mortalità da COVID-19, arrivando a un dimezzamento del tasso di mortalità rispetto all’analisi iniziale (Mortality Rate Ratio = 8%, 95% CI: 2%, 15%)52.
Questi risultati, che hanno fornito molti spunti di riflessione al dibattito scientifico, mostrano, però, importanti limiti tipici degli studi di tipo ecologico. Studiare gli effetti a lungo termine dell’inquinamento atmosferico sulla salute richiede, infatti, l’uso di dati aggregati non solo per quanto riguarda il conteggio dei decessi ma anche per ciò che riguarda le misurazioni ambientali. Attribuire a una determinata superficie geografica una misurazione riassuntiva del PM2,5 implica non tener conto dell’autocorrelazione spaziale, ossia di tutte quelle informazioni derivanti dalla variabilità geografica che potrebbero, in qualche modo, modulare l’effetto dei vari fattori di confondimento sulla mortalità per COVID-19. Inoltre, come osservato nel confronto dei risultati ottenuti nelle due versioni dello studio, è importante tenere conto dei meccanismi di diffusione del virus e delle politiche di controllo adottate, per dare la giusta valutazione al ruolo svolto dall’inquinamento atmosferico all’interno di questa pandemia ed evitare di ottenere associazioni spurie. Per fare questo è necessario condurre studi adeguatamente pianificati, che valutino in maniera prospettica il ruolo svolto dall’esposizione all’inquinamento atmosferico sulla prognosi della COVID-19 sia in maniera indipendente sia interagendo con altri possibili fattori di confondimento.
Conclusioni
Alcuni studi suggeriscono che il virus SARS-CoV-2 si diffonda meno in zone umide e calde e con più facilità nelle regioni fredde e secche, facendo supporre un effetto stagionale sulla trasmissione. Questi studi, però, presentano diverse fonti di distorsione e hanno diverse limitazioni sia dal punto di vista metodologico sia nella qualità dei dati, per questo motivo sono necessari ulteriori approfondimenti.
Inoltre, gli esperti invitano alla cautela nell’interpretazione di questi risultati, in quanto nessun Paese è stato ancora esposto al virus per un intero anno di variazioni stagionali, per cui tutte le supposizioni sono basate su evidenze osservate per altre malattie infettive ed altri ceppi di coronavirus, e su dati limitati per la COVID-19.
Anche l’esposizione ad elevati livelli di inquinamento atmosferico sembra essere associata ad una peggiore prognosi della malattia ma, anche in questo caso, sono necessari studi che permettano di approfondire meglio questo legame tenendo conto delle varie fonti di distorsione.
Bibliografia
- WHO Coronavirus Disease (COVID-19) Dashboard | WHO Coronavirus Disease (COVID-19) Dashboard.
- WHO. Q&A on coronaviruses (COVID-19). Who. 2020. p. 1–15.
- Coronavirus Symptoms: Frequently Asked Questions | Johns Hopkins Medicine.
- Ghani AC, Donnelly CA, Cox DR, Griffin JT, Fraser C, Lam TH, et al. Methods for estimating the case fatality ratio for a novel, emerging infectious disease. Am J Epidemiol . 2005;162(5):479–86.
- Wilder-Smith A, Freedman DO. Confronting the New Challenge in Travel Medicine: SARS . Vol. 10, Journal of Travel Medicine. 2003.
- Roser M, Ritchie H, Ortiz-Ospina E, Hansell J. Mortality Risk of COVID-19 – Statistics and Research – Our World in Data. Mortality Risk of COVID-19. 2020. p. 1. Ultimo accesso: 25 luglio 2020.
- Oke J, Heneghan C. Global Covid-19 Case Fatality Rates. OXFORD CEBM Research. 2020. p. 1–12. Ultimo accesso: 25 luglio 2020.
- Sudharsanan N, Didzun O, Bärnighausen T, Geldsetzer P. The Contribution of the Age Distribution of Cases to COVID-19 Case Fatality Across Countries: A 9-Country Demographic Study. Ann Intern Med. 2020 Jul 22;M20-2973.
- Istituto superiore di sanità (ISS). La mortalità – dati – registri – sorveglianza. 2020.
- Scortichini M, Santos RS dos, Donato FD, Sario M De, Michelozzi P, Davoli M, et al. Excess mortality during the COVID-19 outbreak in Italy: a two-stage interrupted time series analysis. medRxiv. 2020 Jul 24;2020.07.22.20159632.
- Michelozzi P, De’ Donato F, Scortichini M, De Sario M, Asta F, Agabiti N, et al. On the increase in mortality in italy in 2015: Analysis of seasonal mortality in the 32 municipalities included in the surveillance system of daily mortality. Epidemiol Prev. 2016;40(1):22–8.
- Istituto Superiore di Sanità (ISS). Report sulle caratteristiche dei pazienti deceduti positivi all’infezione da SARS-CoV-2 in Italia. Aggiornamento del 22 luglio 2020.
- Riccardo F, Andrianou X, Bella A, Del Manso M, Mateo Urdiales A, Fabiani M, et al. Bollettino della sorveglianza integrata COVID-19. Aggiornamento 25 agosto 2020. Istituto Superiore di Sanità (ISS).
- Global Health 5050. COVID-19 sex-disaggregated data tracker – Global Health 50/50 . 2020. Ultimo accesso: 25 luglio 2020.
- Williamson EJ, Walker AJ, Bhaskaran K, Bacon S, Bates C, Morton CE, et al. OpenSAFELY: factors associated with COVID-19 death in 17 million patients. Nature . 2020 Jul 8;1–11.
- Global Health 5050. Healthcare workers – Global Health 50/50. Ultimo accesso: 25 luglio 2020.
- Istituto Superiore di Sanità. Gender differences in COVID-19: the importance of sex-disaggregated data. Epicentro. 2020
- Shaman J, Kohn M. Absolute humidity modulates influenza survival, transmission, and seasonality. Proc Natl Acad Sci U S A. 2009 Mar 3;106(9):3243–8.
- Price RHM, Graham C, Ramalingam S. Association between viral seasonality and meteorological factors. Sci Rep. 2019 Dec 1;9(1):1–11.
- Gaunt ER, Hardie A, Claas ECJ, Simmonds P, Templeton KE. Epidemiology and Clinical Presentations of the Four Human Coronaviruses 229E, HKU1, NL63, and OC43 Detected over 3 Years Using a Novel Multiplex Real-Time PCR Method. J Clin Microbiol. 2010;48(8):2940–7.
- Nassar MS, Bakhrebah MA, Meo SA, Alsuabeyl MS, Zaher WA. Global seasonal occurrence of Middle East Respiratory Syndrome Coronavirus (MERS-CoV) infection. Vol. 22, European Review for Medical and Pharmacological Sciences. 2018. p. 3913–8.
- Al-Ahmadi K, Alahmadi S, Al-Zahrani A. Spatiotemporal clustering of middle east respiratory syndrome coronavirus (MERS-CoV) incidence in Saudi Arabia, 2012–2019. Int J Environ Res Public Health. 2019 Jul 2;16(14).
- Altamimi A, Ahmed AE. Climate factors and incidence of Middle East respiratory syndrome coronavirus. J Infect Public Health. 2020 May 1;13(5):704–8.
- Chin AWH, Chu JTS, Perera MRA, Hui KPY, Yen H-L, Chan MCW, et al. Stability of SARS-CoV-2 in different environmental conditions. The Lancet Microbe. 2020 May 1;1(1):e10.
- Qi H, Xiao S, Shi R, Ward MP, Chen Y, Tu W, et al. COVID-19 transmission in Mainland China is associated with temperature and humidity: A time-series analysis. Sci Total Environ. 2020 Aug 1;728:138778.
- Wang J, Tang K, Feng K, Li X, Lv W, Chen K, et al. High Temperature and High Humidity Reduce the Transmission of COVID-19. SSRN Electron J. 2020 Mar 9.
- Scafetta N. Distribution of the SARS-CoV-2 pandemic and its monthly forecast based on seasonal climate patterns. Int J Environ Res Public Health. 2020 May 17;17(10):3493.
- Ficetola GF, Rubolini D. Climate affects global patterns of COVID-19 early outbreak dynamics. medRxiv. 2020 Apr 20;2020.03.23.20040501.
- Sajadi MM, Habibzadeh P, Vintzileos A, Shokouhi S, Miralles-Wilhelm F, Amoroso A. Temperature, Humidity, and Latitude Analysis to Estimate Potential Spread and Seasonality of Coronavirus Disease 2019 (COVID-19). JAMA Netw open. 2020 Jun 1;3(6):e2011834.
- Wu Y, Jing W, Liu J, Ma Q, Yuan J, Wang Y, et al. Effects of temperature and humidity on the daily new cases and new deaths of COVID-19 in 166 countries. Sci Total Environ. 2020 Aug 10;729:139051.
- Islam N, Shabnam S, Erzurumluoglu AM. Temperature, humidity, and wind speed are associated with lower Covid-19 incidence. medRxiv. 2020 Mar 31;2020.03.27.20045658.
- Jamil T, Alam IS, Gojobori T, Duarte C. No Evidence for Temperature-Dependence of the COVID-19 Epidemic. medRxiv. Cold Spring Harbor Laboratory Press; 2020 Apr.
- Jüni P, Rothenbühler M, Bobos P, Thorpe KE, Da Costa BR, Fisman DN, et al. Impact of climate and public health interventions on the COVID-19 pandemic: A prospective cohort study. CMAJ. 2020 May 25;192(21):E566–73.
- Xu R, Rahmandad H, Gupta M, DiGennaro C, Ghaffarzadegan N, Amini H, et al. The Modest Impact of Weather and Air Pollution on COVID-19 Transmission. medRxiv. 2020.
- Rapid Expert Consultation on SARS-CoV-2 Survival in Relation to Temperature and Humidity and Potential for Seasonality for the COVID-19 Pandemic (April 7, 2020). National Academies Press; 2020.
- Gilbert M, Pullano G, Pinotti F, Valdano E, Poletto C, Boëlle PY, et al. Preparedness and vulnerability of African countries against importations of COVID-19: a modelling study. Lancet. 2020 Mar 14;395(10227):871–7.
- Peeri NC, Shrestha N, Rahman MS, Zaki R, Tan Z, Bibi S, et al. The SARS, MERS and novel coronavirus (COVID-19) epidemics, the newest and biggest global health threats: what lessons have we learned? IEA Int Epidemiol Assoc Int J Epidemiol. 2020:1–10.
- Gostic KM, Gomez ACR, Mummah RO, Kucharski AJ, Lloyd-Smith JO. Estimated effectiveness of symptom and risk screening to prevent the spread of COVID-19. Elife. 2020;9.
- Chinazzi M, Davis JT, Ajelli M, Gioannini C, Litvinova M, Merler S, et al. The effect of travel restrictions on the spread of the 2019 novel coronavirus (COVID-19) outbreak. Science (80- ). 2020 Apr 24;368(6489):395–400.
- Lee VJ, Chiew CJ, Khong WX. Interrupting transmission of COVID-19: lessons from containment efforts in Singapore. J Travel Med. 2020;2020:1–5.
- Luo W, Majumder MS, Liu D, Poirier C, Mandl KD, Lipsitch M, et al. The role of absolute humidity on transmission rates of the COVID-19 outbreak. medRxiv. 2020 Feb 17;7.
- Poirier C, Luo W, Majumder M, Liu D, Mandl K, Mooring T, et al. The Role of Environmental Factors on Transmission Rates of the COVID-19 Outbreak: An Initial Assessment in Two Spatial Scales. SSRN Electron J. 2020 Mar 13.
- Setti L. Evaluation of the potential relationship between Particulate Matter (PM) pollution and COVID-19 infection spread in Italy. Società Italiana di Medicina Ambientale (SIMA).
- Setti L, Passarini F, De Gennaro G, Barbieri P, Perrone MG, Borelli M, et al. SARS-Cov-2RNA found on particulate matter of Bergamo in Northern Italy: First evidence. Environ Res. 2020 Sep 1;188:109754.
- Società Italiana di Aerosol. Information on the relationship between air pollution and the spread of COVID-19.
- Carla Ancona PALB et. altri (2020). Inquinamento atmosferico e epidemia COVID-19: la posizione della Rete Italiana Ambiente e Salute – E&P Repository.
- Contini D, Costabile F. Does air pollution influence COVID-19 outbreaks?. Vol. 11, Atmosphere. MDPI AG; 2020. p. 377.
- Baldini M, Bartolacci S, Bortone G, et. al (2020). Valutazione del possibile rapporto tra l’inquinamento atmosferico e la diffusione del SARS-CoV-2. E&P Repository.
- Rete Italiana Ambiente e Salute. Inquinamento atmosferico e COVID-19: la posizione della Rete Italiana Ambiente e Salute | Scienza in rete.
- WHO. Ambient (outdoor) air pollution. 2018.
- Conticini E, Frediani B, Caro D. Can atmospheric pollution be considered a co-factor in extremely high level of SARS-CoV-2 lethality in Northern Italy? Vol. 261, Environmental Pollution. Elsevier Ltd; 2020. p. 114465.
- Wu X, Nethery RC, Sabath BM, Braun D, Dominici F. Exposure to air pollution and COVID-19 mortality in the United States. medRxiv. 2020 Apr 27;2020.04.05.20054502.



 Scarica il PDF dell'articolo
Scarica il PDF dell'articolo
Pingback: Unione Europea e qualità dell’aria