di Federica Facciotti
Laboratorio di immunità mucosale, Istituto Europeo di Oncologia (IEO)
Indice dei contenuti
- Introduzione
- Principi dei test sierologici
- Generazione e validazione dei test sierologici
- Parametri specifici analitici e clinici di un test diagnostico
- Tipi di test sierologici esistenti
- Quando sono utili i test sierologici
- Questioni aperte
“Per non esperti”
- Risposta immunitaria umorale contro il SARS-CoV-2
- Epitopi
- Cinetica della comparsa delle varie immunoglobuline
- Curva ROC
- Produzione degli antigeni virali in laboratorio
Bibliografia
Introduzione
Il virus SARS-CoV-2 è stato scoperto a Wuhan, in Cina, alla fine del 2019 e si è diffuso velocemente in tutto il mondo. La malattia associata al coronavirus 2019 (COVID-19) è diventata in pochi mesi una pandemia globale, in grado di causare mortalità e morbilità significative1. La maggior parte dei governi ha messo in atto severe misure di isolamento nel tentativo di contenere le infezioni. In attesa che siano resi disponibili vaccini efficaci e opzioni terapeutiche risolutive, diversi strumenti diagnostici, tra cui i test sierologici, sono stati elementi cardine della politica di salute pubblica per controllare l’ulteriore diffusione del virus. In particolare, i test sierologici sono stati e sono tuttora sempre più usati per fornire una più ampia comprensione dell’incidenza di COVID-19 nella popolazione e per valutarne lo stato di immunità.
Analogamente a quanto accade dopo l’incontro con altri patogeni, i pazienti sopravvissuti alla COVID-19 sviluppano anticorpi che riconoscono proteine del virus SARS-CoV-22. Questi anticorpi sono presenti nei fluidi corporei, inclusi sangue, siero (motivo per cui sono chiamati test sierologici), plasma e saliva. Quindi, si può dire che i test anticorpali sono gli strumenti che misurano uno degli esiti funzionali della risposta immunitaria, quello umorale.
I test sierologici indicano se una persona ha generato una risposta immunitaria umorale contro il SARS-CoV-2 nel recente passato. Al contrario, il test molecolare della reazione a catena della polimerasi (PCR) per la COVID-19 è uno strumento diagnostico che rileva la presenza nel momento in cui è effettuato il test dell’RNA virale nei fluidi del paziente (per esempio, tamponi nasali e faringei) e indica se il soggetto stia ancora trasportando il virus e sia quindi ancora potenzialmente contagioso.
Esistono diversi tipi di test sierologici. Alcuni possono dare risultati in meno di 30 minuti e possono essere eseguiti in punti di prelievo (POC, Point Of Care), mentre altri devono essere necessariamente effettuati in laboratorio, come i test ELISA, e possono richiedere piattaforme tecnologiche dedicate, come i saggi di immunochemiluminescenza (CLIA). L’affidabilità dei diversi test può variare grandemente3,4; inoltre i test serologici potrebbero risentire del fatto che gli anticorpi potrebbero scomparire gradualmente dal sangue dei pazienti con il passare del tempo5,6.
Principi dei test sierologici
Gli anticorpi anti-SARS-CoV-2 riconoscono piccole porzioni proteiche del virus, detti epitopi.
Tutti i test sierologici si basano sullo stesso principio: le proteine derivate dal virus vengono attaccate a un supporto plastico, quindi il campione biologico prelevato dai pazienti (sangue, siero, plasma, saliva) viene esposto a queste proteine e a un enzima. Viene poi applicato un reagente chimico. Se nel campione sono presenti gli anticorpi specifici che riconoscono il virus SARS-CoV-2, questi si legano agli antigeni virali sulla plastica. L’enzima, se è presente il complesso antigene-anticorpo, attiva il reagente chimico, provocando una reazione colorimetrica.
Nei saggi ELISA o CLIA la rilevazione di uno specifico segnale di luminescenza indica un risultato positivo. Se confrontata con un campione di controllo di riferimento, l’intensità del segnale è indice della quantità di anticorpi nel campione in esame (si ottiene il cosiddetto titolo anticorpale). I test rapidi o saggi a flusso laterale, possono invece fornire solo un risultato positivo o negativo e non sono in grado di quantificare il titolo virale nel campione. I test sierologici possono essere utilizzati anche per valutare la capacità degli anticorpi di neutralizzare il virus.
Per sviluppare un test diagnostico sierologico è necessario identificare e produrre in grande quantità gli antigeni proteici virali da usare come target. Il genoma del SARS-CoV-2 codifica circa 25 proteine necessarie per l’infezione e la replicazione, comprese quattro principali proteine strutturali: Spike (S), Envelope (E), Membrane (M) e Nucleocapside (N). La proteina S svolge un ruolo critico per la fusione e l’ingresso nella cellula ospite e comprende un dominio di legame del recettore S1 N-terminale (RBD), il dominio N-terminale (NTD) e una subunità S2 C-terminale. La funzione primaria della proteina SARS-CoV-2 N (NP) è invece legare e impacchettare il genoma dell’RNA virale in una struttura nucleocapsidica elicoidale durante la replicazione virale7,8. In questo momento praticamente tutte le proteine virali sono state usate per generare dei saggi serologici7.
Generazione e validazione dei test sierologici
In particolare l’affidabilità (o performance) di un test è valutata attraverso:
- la ripetibilità di un certo risultato (nota anche come precisione all’interno del test). Si calcola attraverso il coefficiente di variazione (Cv) della misura dello stesso campione su almeno 30 test eseguiti;
- la riproducibilità intralaboratorio, che misura il coefficiente di variazione di campioni standard testati più volte;
- la riproducibilità del test in diversi laboratori (precisione tra osservatori) che esprime la concordanza dei risultati sugli stessi campioni ottenuti in laboratori diversi.
Inoltre, per valutare le prestazioni dei test sierologici esistono due parametri importati: la sensibilità e la specificità.
I test altamente sensibili sono in grado di rilevare con elevata precisione se le persone hanno anticorpi specifici anti-SARS-COV-2 presenti nel sangue. In altre parole, la sensibilità di un test indica quanti soggetti positivi possono essere rilevati. Se vengono testati 100 campioni positivi e il test è sufficientemente accurato da rilevarli tutti, il test ha il 100% di sensibilità. Minore è la sensibilità, maggiore è la probabilità di risultati falsi negativi (poiché il test non è in grado di rilevare tutti i veri positivi e li restituisce come falsi negativi).
Se un test è descritto come altamente specifico, significa che può rilevare in modo affidabile le persone che non hanno anticorpi anti-SARS-COV-2 (i soggetti negativi). Se vengono testati 100 campioni negativi e il test è sufficientemente accurato da rilevare che tutti sono negativi, il test ha il 100% di specificità. Minore è la specificità, maggiore è la probabilità di risultati falsi positivi (perché il test non è in grado di rilevare tutti i veri negativi e li restituisce come falsi positivi).
Specificità e sensibilità dei diversi saggi variano notevolmente tra i diversi metodi a disposizione, sia perché le diverse tecniche implementate (ELISA, CLIA, flusso laterale) sono molto diverse tra loro e hanno differenti caratteristiche tecniche intrinseche, sia perché in diversi test vengono usati antigeni diversi con diversa immunogenicità (Spike ectodomain, S1-S2 of the Spike, Spike RBD, Nucleocapside).
Per esempio, poiché la proteina Nucleocapside è quella più conservata tra i diversi coronavirus9, i test sierologici che usano N come antigene possono dare origine a falsi positivi come conseguenza di una rilevazione errata di anticorpi anti-N presenti nei campioni ma generati contro i comuni coronavirus del raffreddore. Questi anticorpi non sono specifici per la proteina nucleocapside SARS-CoV-2, ma poiché riconoscono la proteina N di coronavirus precedenti, che ha una struttura e sequenza estremamente simile a quella di SARS-Cov2, possono comunque legarsi alla proteina N del virus attuale. Al contrario, le proteine Spike sono più diverse tra i diversi coronavirus, quindi consentono di discriminare meglio tra anticorpi anti-Spike generati contro il SARS-Cov2 o contro coronavirus precedenti.
Parametri specifici analitici e clinici di un test diagnostico
Un parametro importante dei test è la sensibilità analitica (o limite di rilevamento), che denota la più piccola quantità di sostanza in esame in un campione che può essere rilevata. Può essere misurata mediante diluizione del siero limite fino alla quella per la quale non vengono più rilevati anticorpi su almeno 30 sieri. Questo valore corrisponde al valore di soglia di positività che è determinato attraverso la curva ROC. Il limite di rilevamento di un test dipende dalla coorte di campioni utilizzata per convalidare il test. Poiché il titolo anticorpale è correlato all’entità della risposta immunitaria, per includere il più ampio spettro di risultati possibili (titolo anticorpale alto/medio/basso) è necessario convalidare il test con sieri ottenuti da pazienti che hanno manifestato malattie gravi/lievi/molto lievi (controlli positivi) e con controlli veri negativi, ovvero sieri ottenuti da persone che non sono mai state esposte al virus (per esempio, sieri raccolti prima della pandemia).
- La specificità analitica denota la capacità del test di non mostrare reazioni aspecifiche verso altre sostanze, nel caso della COVID-19 con altri anticorpi mirati contro virus correlati al SARS-CoV-2, come i virus che causano comuni infezioni respiratorie o altri composti noti per dare reazioni aspecifiche (fattore reumatoide in particolare). La specificità analitica del test sierologico è stabilita testando sieri noti che contengono anticorpi contro virus responsabili di infezioni respiratorie (altri coronavirus, tra cui i β-coronavirus OC43 e HKU1 e gli α-coronavirus NL63 e 229), virus influenzali (una reazione con quest’ultimi indica un grave problema rispetto alla specificità analitica del test), fattore reumatoide o sieri di soggetti che presentano altre infezioni (malaria, dengue ecc.).
- La sensibilità clinica è valutata dalla capacità di rilevare anticorpi (IgM e/o IgG) contro il virus SARS-CoV-2 in sieri di soggetti precedentemente noti per essere stati infettati dal SARS-CoV-2, cioè per i quali la presenza del virus è stata rigorosamente confermata con un test RT-PCR positivo (i veri positivi). Poiché la sensibilità clinica dei test sierologici può variare in base al periodo di campionamento del test (per esempio, prima o seconda settimana dopo la comparsa dei sintomi, v. approfondimento sulla cinetica della risposta), il pannello di siero utilizzato per convalidare la sensibilità clinica deve essere documentato esplicitamente (numero totale di sieri inclusi nel pannello, numero di sieri per ogni periodo di 5 giorni dopo la comparsa dei sintomi, proporzione relativa di sieri ottenuti da pazienti sintomatici/asintomatici nel pannello). In teoria, ci si aspetta una sensibilità clinica del 100% per ridurre al minimo il numero di falsi negativi.
- La specificità clinica consiste nella probabilità di ottenere un test negativo in assenza di malattia, ovvero garantire che il test non rilevi anticorpi (IgM e/o IgG) contro il virus SARS-CoV-2 nei sieri di donatori sani (per esempio, donatori pre-epidemici). Al fine di ridurre al minimo il numero di falsi positivi e sulla base delle attuali conoscenze, il valore soglia minimo accettabile per la specificità clinica è stimato al 98% indipendentemente dai test sierologici.
Tipi di test sierologici esistenti
Esistono quattro tipi principali di test diagnostici sierologici: il test diagnostico rapido (RDT), il test ELISA, il test immunologico di chemiluminescenza (CLIA) e il test di neutralizzazione.
Test diagnostico rapido (RDT)
Il test diagnostico rapido (RTD) è in genere un test portatile colorimetrico basato sulla tecnologia “a flusso laterale” (LFIA). È un test qualitativo (risultato sì/no → positivo/negativo) e può essere facilmente applicato presso i punti di prelievo (POC) o utilizzato come autotest. Questi test si possono usare per analizzare campioni di sangue ottenuto da una puntura del dito, campioni di saliva o liquidi da tampone nasale. Gli RDT sono concettualmente simili ai test di gravidanza, in quanto il test mostra all’utente linee colorate per indicare risultati positivi o negativi.
Negli RDT gli anticorpi presenti nel sangue migrano attraverso una matrice adesiva (per esempio, nitrocellulosa) e interagiscono con gli antigeni specifici del virus e gli anticorpi secondari (per esempio, anticorpi anti-IgM/IgG) legati alla matrice stessa. Se presenti nel campione, gli antigeni coniugati specifici per il SARS-CoV-2 si legano agli anticorpi corrispondenti. Quando i complessi anticorpo-antigene migrano attraverso la membrana, gli anticorpi IgM anti-SARS-CoV-2 legati interagiscono con gli anticorpi secondari anti-IgM fissati sulla linea M (M da IgM) della matrice, mentre gli anticorpi IgG anti-SARS-CoV-2 interagiscono con gli anticorpi anti-IgG sulla linea G (G da IgG). Se il campione di sangue non contiene anticorpi specifici per il SARS-CoV-2, le linee M o G non compaiono nei risultati finali del test; viene rivelata solo la linea di controllo (C) (Figura1).
Figura 1 Rappresentazione schematica di test diagnostici rapidi (RDT).
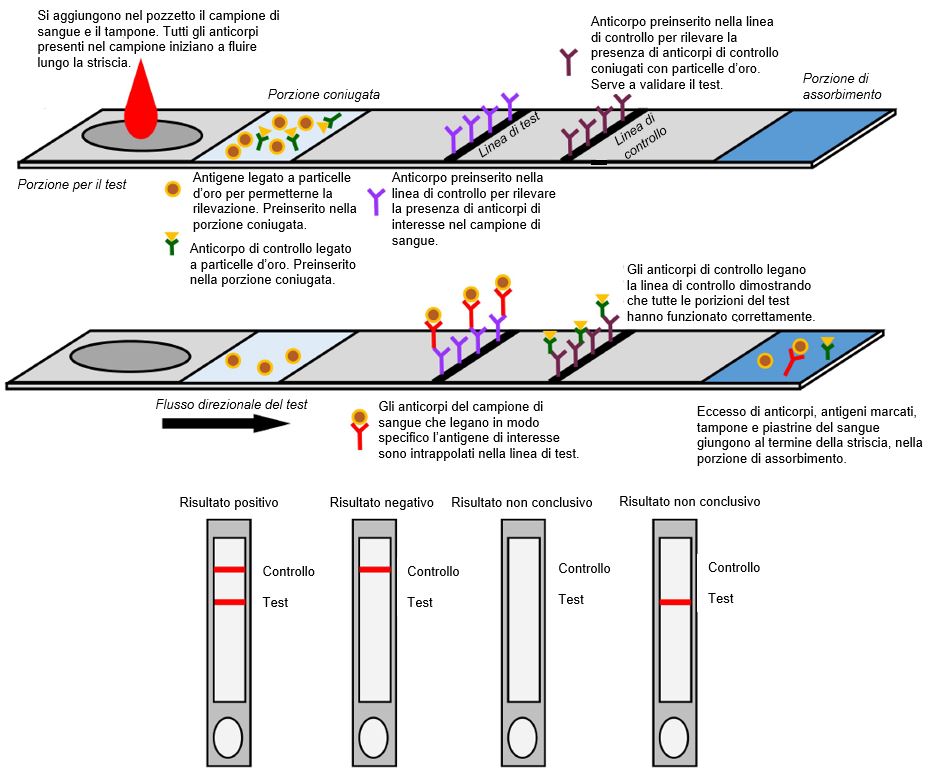
[Disegnato con Biorender da AngelicaDiaz-Basabe, Università di Milano]
Il test RDT è molto semplice da usare e restituisce il risultato in un tempo compreso tra i 10 e 30 min. Pertanto, ha il potenziale per essere usasto in indagini sierologiche su larga scala. Ciononostante, non tutti i test RTD si sono rivelati particolarmente accurati sia in termini di sensibilità sia di specificità10,11.
Test ELISA
Il test ELISA è attualmente il formato più comunemente usato per i test sierologici per la COVID-19. Si tratta di un test di laboratorio che richiede un tempo medio per il risultato di 2–5 ore. Il test ELISA prevede l’uso di una superficie plastica (chiamata piastra) rivestita con uno o più antigeni virali che possono legare e rilevare i corrispondenti anticorpi presenti nel campione del paziente. I test ELISA possono identificare diverse classi di anticorpi, per esempio IgM, IgG e IgA.
Il test ELISA convenzionale prevede l’uso di molecole reporter e substrati cromogenici in grado di produrre cambiamenti di colore per indicare la presenza degli anticorpi antivirus nel campione.
In questo test, l’antigene virale (perlopiù prodotto in maniera ricombinante in grande quantità in laboratorio) viene legato su una superficie solida, solitamente su una piastra a 96 o 384 micropozzetti, e successivamente interagisce con un antigene/anticorpo secondario. La controparte antigene anticorpo è collegata a una molecola reporter, di solito un enzima, o in alternativa può essere rilevata da un anticorpo secondario che è a sua volta collegato tramite coniugazione a un enzima. La rilevazione del saggio viene effettuata valutando l’attività enzimatica attraverso l’incubazione con un substrato adatto per l’enzima. Il prodotto della reazione enzima-substrato viene quindi quantificato.
La tecnica ELISA dà come risultato un prodotto finale colorato che assorbe a una particolare lunghezza d’onda e può essere correlato alla quantità di analita (in questo caso gli anticorpi) presenti nel campione. Un’interazione anticorpo-antigene estremamente specifica è la componente più critica dell’intero processo. La possibilità di eliminare attraverso lavaggi gli anticorpi non specifici e, quindi, non legati rende la tecnica ELISA un saggio affidabile per ottenere informazioni precise sulla presenza anche minima di anticorpi in campioni complessi e poco puri come i fluidi corporei.
I test ELISA possono essere trovati in diversi formati tra cui il test diretto, competitivo e, il più comunemente usato, il test sandwich o doppio antigene-bridging assay (DABA) (Figura 2).
Figura 2 Rappresentazione schematica di test ELISA.
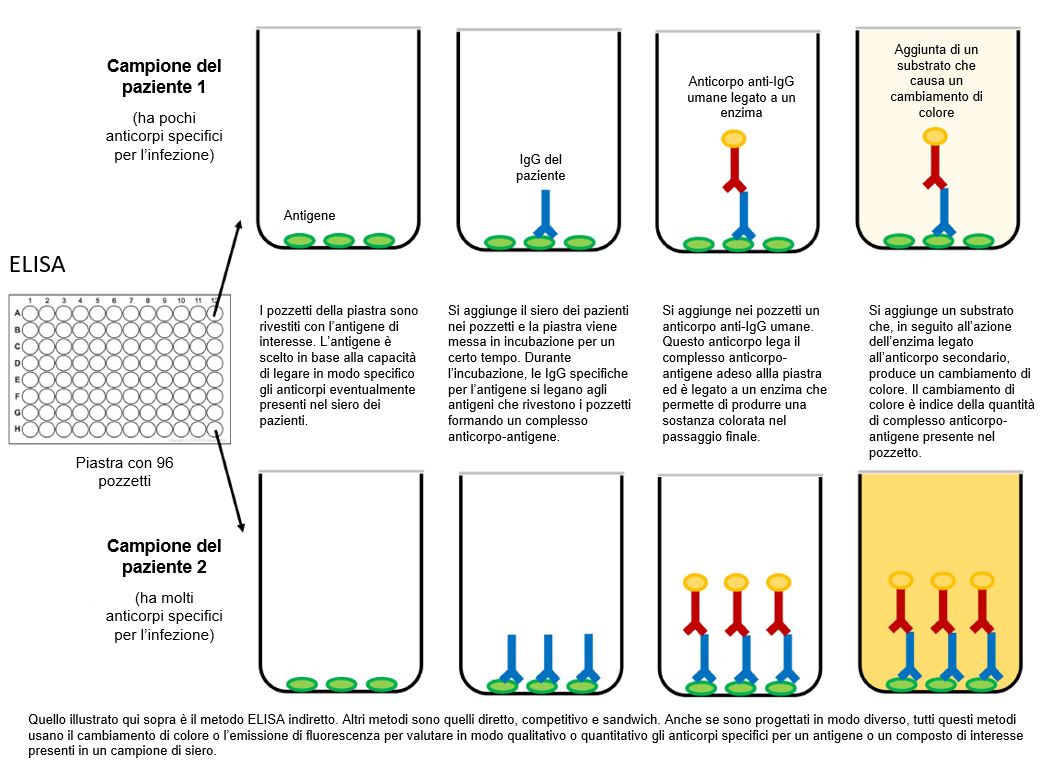
[Disegnato con Biorender da AngelicaDiaz-Basabe, Università di Milano]
Test di chemiluminescenza (CLIA)
La tecnologia CLIA (ChemiLuminescent ImmunoAssay) o test di chemiluminescenza si basa su un concetto simile all’ELISA, cioè sfrutta l’elevata affinità di legame tra gli antigeni virali e gli anticorpi dell’ospite. A differenza dell’ELISA, però, usa sonde chimiche che producono emissione di luce attraverso una reazione chimica; l’emissione di luce indica un segnale positivo. Il test CLIA ha un tempo medio per il risultato di 1–2 ore. CLIA ed ELISA sono entrambi saggi di laboratorio ad alto rendimento, cioè possono essere usati per testare un numero molto alto di campioni. Questo test è tipicamente quantitativo e può essere eseguito solo con piattaforme dedicate. Può essere usato con campioni di sangue intero, plasma o siero dei pazienti. Una variazione di questo test prevede l’uso di microparticelle magnetiche rivestite di proteine, note come immunodosaggio di microparticelle chemiluminescenti. Il test si basa sulla miscelazione di campioni di pazienti con una proteina virale nota, reagenti tampone e specifici anticorpi marcati con enzimi che consentono una lettura luminescente basata sulla luce.
Qualsiasi anticorpo nel campione del paziente che reagisce alla proteina virale forma un complesso. Vengono quindi aggiunti anticorpi (secondari) marcati con enzimi che si legano a questi complessi. Questo legame induce una reazione chimica che produce luce. La quantità di luce (radianza) emessa da ciascun campione viene quindi usata per calcolare il numero di anticorpi presenti in un campione del paziente. Come l’ELISA, anche il CLIA permette l’analisi di più tipi di anticorpi, inclusi IgG, IgM e IgA (Figura 3).
Figura 3 Rappresentazione schematica di un test di chemiluminescenza (CLIA).
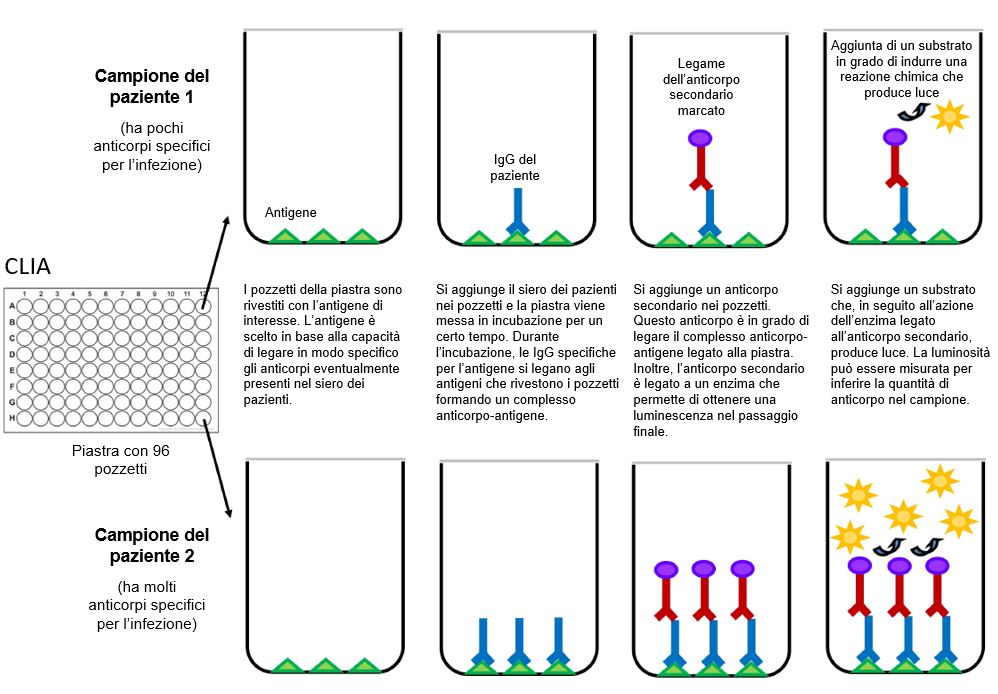 [Disegnato con Biorender da AngelicaDiaz-Basabe, Università di Milano]
[Disegnato con Biorender da AngelicaDiaz-Basabe, Università di Milano]
Test di neutralizzazione
Il test di neutralizzazione è un test di laboratorio basato sull’uso di metodi di coltura cellulare e virus vivi per determinare se gli anticorpi del paziente possono prevenire l’infezione virale in vitro. Questo test deve essere eseguito in laboratori con certificati di biosicurezza designati per la coltura di cellule infettate da SARS-CoV-2 (di solito sono laboratori definiti di biocontenimento di livello 3, BSL3) e ha un tempo di risultato di 3–5 giorni.
Il test di neutralizzazione si basa sul concetto che gli anticorpi del paziente possono essere in grado di legare il virus e prevenirne perciò la capacità di infettare le cellule (Figura 4). I test di neutralizzazione possono rivelare se un paziente ha anticorpi attivi ed efficaci contro il virus, anche se hanno già eliminato l’infezione. Questi test richiedono campioni di sangue intero, siero o plasma dal paziente. I test di neutralizzazione dipendono dalla coltura cellulare, un metodo di laboratorio di coltura di cellule particolari che consentono la crescita del virus SARS-CoV-2 (come le cellule VeroE6). Quando il virus e le cellule crescono in presenza di concentrazioni decrescenti di anticorpi dei pazienti, è possibile visualizzare e quantificare quanti anticorpi nel siero sono in grado di bloccare la replicazione del virus. Questa azione di blocco può avvenire attraverso il legame dell’anticorpo a un’importante proteina di ingresso cellulare del virus. Gli studi sul siero di pazienti con COVID-19 suggeriscono che gli anticorpi neutralizzanti agiscono principalmente contro la proteina S e in misura minore contro le proteine N12,13 e sono efficaci solo a titoli anticorpali alti14,15.
Figura 4 Rappresentazione schematica di test di neutralizzazione.
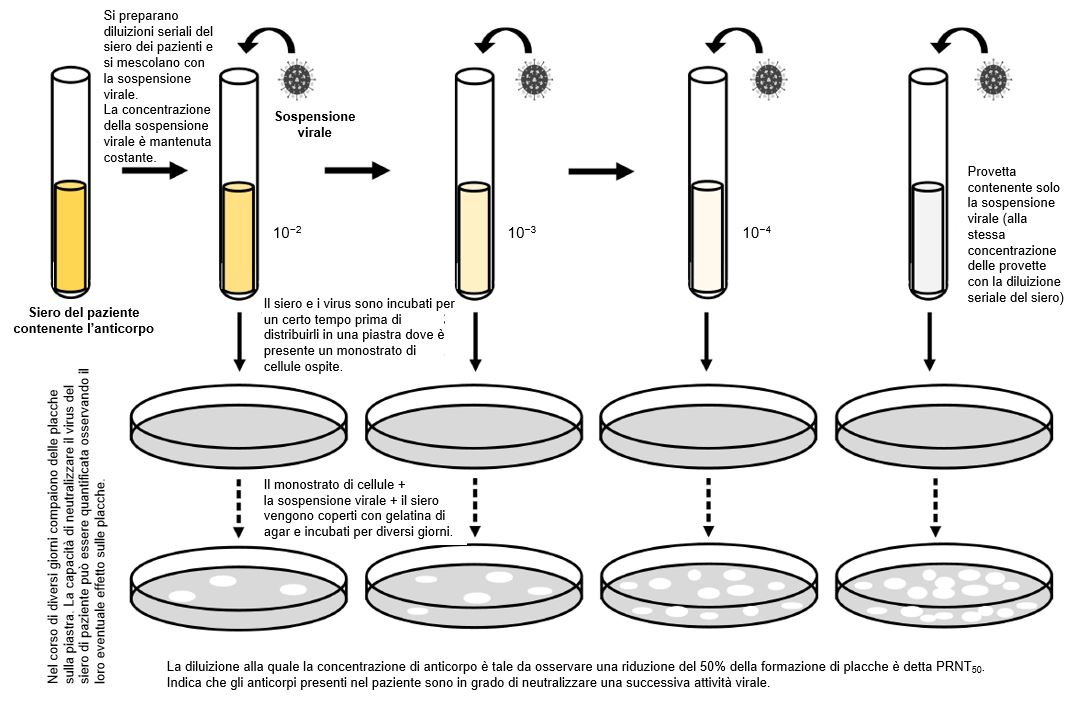
[Disegnato con Biorender da AngelicaDiaz-Basabe, Università di Milano]
La seguente tabella confronta le caratteristiche principali dei diversi metodi descritti.
| TIPI DI TEST | TEMPO PER AVERE IL RISULTATO | COSA DICE | COSA NON DICE |
| RDT | 10–30 minuti | Presenza o assenza qualitativa di anticorpi anti-SARS-CoV2 | Il titolo anticorpale |
| ELISA | 2–4 ore | Presenza o assenza quantitativa di anticorpi anti-SARS-CoV2 | Se gli anticorpi sono in grado di bloccare la replicazione virale |
| CLIA | 1–2 ore | Presenza o assenza quantitativa di anticorpi anti-SARS-CoV2 | Se gli anticorpi sono in grado di bloccare la replicazione virale |
| Neutralizzazione | 3–5 giorni | Presenza o assenza di anticorpi attivi nei fluidi del paziente in grado di neutralizzare la crescita virale in un saggio cellulare in vitro | Potrebbe non riconoscere anticorpi contro proteine virali che non sono coinvolte nei processi di replicazione virale |
Quando sono utili i test sierologici
I test serologici sono utili per determinare se una persona è stata a contatto con il virus, se ha sviluppato una risposta immunitaria e, in base al tipo di classe di immunoglobuline rilevata (IgM, IgA, IgG), possono fornire una stima temporale di quando ha incontrato il virus. È importante sottolineare che la presenza di anticorpi non esclude che la persona che li possiete possa essere ancora contagioso e potrebbe potenzialmente ancora diffondere il virus. Queste informazioni possono essere fornite solo dopo il test molecolare e la rilevazione o meno dell’RNA virale.
Sorveglianza
I test sierologici possono essere usati per stabilire la reale estensione di un focolaio infettivo, mappare la sua distribuzione geografica e identificare le zone e le popolazioni particolarmente a rischio. Questa informazione è molto importante per aiutare la classe dirigente a deliberare sulle misure di salute pubblica e sulle strategie di controllo della diffusione dell’epidemia. Per una sorveglianza efficace, tuttavia, è fondamentale:
- usare test molto affidabili in termini di prestazioni;
- usare sempre lo stesso test una volta deciso quale utilizzare (ELISA, CLIA);
- identificare un numero di campioni positivi e negativi da usare per controllare internamente le prestazioni del test;
- identificare una coorte di soggetti positivi e negativi da seguire longitudinalmente come popolazioni sentinella per la positività anticorpale nella popolazione positiva per la COVID-19, poiché è stato visto che il titolo anticorpale diminuisce nel tempo. In effetti, la negatività degli anticorpi dopo diversi mesi dall’incontro con il virus potrebbe semplicemente riflettere la cinetica della scomparsa delle immunoglobuline nei fluidi corporei.
La sorveglianza attiva con i test serologici può essere eseguita in combinazione con i test molecolari tra comunità particolarmente fragili (per esempio, pazienti immunocompromessi o neoplastici) o tra popolazioni fortemente esposte al virus (come gli operatori sanitari).
Triage rapido di individui sintomatici in contesti comunitari
A condizione che il test sierologico usato sia altamente accurato, in caso di accesso limitato ai test molecolari per un gran numero di persone, è possibile usare test rapidi o test ELISA/CLIA per valutare rapidamente i casi sospetti di COVID-19. I test sierologici sono più economici dei test molecolari e nella maggior parte dei casi forniscono un risultato più rapido. L’approccio della ricerca degli anticorpi per definire se una persona è effettivamente entrata in contatto con il virus è efficace 4–7 giorni dopo l’insorgenza dei sintomi, tempo necessario per consentire al sistema immunitario di iniziare a produrre la prima ondata di immunoglobuline IgM specifiche per il virus.
I casi sospetti devono essere confermati con i test molecolari. Un risultato (falso) negativo può riflettere la finestra temporale in cui è stato eseguito il test: un test sierologico eseguito entro i primi 3–5 giorni dall’esposizione al virus potrebbe infatti restituire un risultato negativo solo perché le immunoglobuline non sono ancora prodotte o sono presenti a una concentrazione (titolo) al di sotto del limite di rilevamento del test.
Con tutte le limitazioni del caso, questo approccio può essere utile per quei Paesi con restrizioni per eseguire test molecolari su una gran numero di persone, per motivi economici o perché non hanno abbastanza laboratori specializzati per eseguire i test molecolari, e consente di stabilire la priorità per le analisi diagnostiche.
Testare tutti i contatti di persone con COVID-19 confermato
Per interrompere la catena di trasmissione e contenere l’epidemia, è fondamentale rintracciare tutti i contatti di persone con COVID-19 confermato, testarli per provare l’avvenuta infezione, indipendentemente dai sintomi e mettere in isolamento quei contatti che risultano positivi. Questo approccio è importante sia nelle prime fasi dell’epidemia, quando ci sono gruppi di casi che devono essere contenuti, sia alla fine del picco, per ridurre l’entità dell’infezione nella comunità.
Sia i soggetti sieropositivi sia quelli sieronegativi dovrebbero essere testati anche per la presenza di RNA con test molecolari. In caso di risorse economiche ridotte o accesso limitato ai reagenti per i test molecolari, la priorità dovrebbe essere data ai test di soggetti negativi per escludere l’infettività in assenza di anticorpi e, quindi, ai sieropositivi per verificare se questi soggetti sono ancora infettivi.
Inoltre, negli individui che risultano negativi al test IgG, se le risorse lo consentono, potrebbe essere utile eseguire un test anticorpale di follow-up 10–14 giorni dopo per documentare una diagnosi definitiva attraverso la sieroconversione.
Chi non dovrebbe essere testato
I test sierologici sono strumenti diagnostici molto utili, tenendo presente che hanno limiti intrinseci e che forniscono solo informazioni molto specifiche. Per esempio, l’uso di test sierologici per le indagini sulla popolazione non è raccomandato in contesti a bassa prevalenza poiché questo approccio probabilmente porterà a ottenere più falsi positivi rispetto a quelli veri positivi, anche se viene usato un test con alta specificità. In altre parole, se la prevalenza dell’infezione è dell’1% nella popolazione generale, un ottimo test con il 98% di specificità restituisce due falsi positivi per ogni risultato vero positivo.
I pazienti in una fase iniziale del decorso della malattia (entro i primi 3–5 giorni), o i pazienti asintomatici o paucisintomatici, potrebbero avere basse concentrazioni di anticorpi che potrebbero dare risultati falsi negativi. Inoltre, i campioni biologici usati nei test sierologici sono composti biologici complessi, che contengono molte altre proteine, oltre agli anticorpi. La presenza di comorbidità e infiammazione non correlata al SARS-COV-2 potrebbe inoltre alterare la viscosità del campione, rendendolo “più appiccicoso” e quindi incline a fornire un risultato falso positivo.
In generale, i test sierologici non dovrebbero essere considerati uno strumento per definire chi ha ottenuto un’immunità protettiva. Sebbene diversi rapporti indichino che gli anticorpi contro la proteina Spike Sars-COV-2 possiedono attività neutralizzanti, non ci sono attualmente dati sufficienti per indicare se una persona esposta al virus una volta non possa essere reinfettata e non possa essere nuovamente contagiosa. Inoltre, gli anticorpi possono essere molto importanti, ma lo stesso può essere la risposta di altre popolazioni di cellule immunitarie, per esempio i linfociti T.
Questioni aperte
Sebbene i test sierologici abbiano importanti applicazioni diagnostiche ed epidemiologiche, alcune domande rimangono ancora aperte.
La presenza di anticorpi significa che la persona è immune?
Ad agosto 2020, nessuno studio sugli esseri umani ha ancora valutato se la presenza di anticorpi contro SARS-CoV-2 conferisca immunità alla successiva infezione da questo virus. Le risposte immunitarie a un patogeno sono complesse e coinvolgono non solo la produzione di anticorpi ma anche lo sviluppo di risposte cellulari, che non sono valutate da test sierologici e possono essere fondamentali per conferire piena protezione a una seconda esposizione al virus. Inoltre, alcune persone risultate positive ai test sierologici hanno livelli molto bassi di anticorpi, che potrebbero non essere sufficienti per neutralizzare il virus nel sangue5,6,16,17.
Quanto durano gli anticorpi?
Pubblicazioni recenti indicano che i titoli anticorpali diminuiscono rapidamente entro tre mesi dalla comparsa dei sintomi5,6,16,17. È importante dire che la persistenza degli anticorpi dipende in gran parte dal tipo della risposta immunitaria, dall’entità della risposta e dalla natura dell’agente patogeno. Per fare dei paragoni, la nostra immunità all’influenza stagionale tende a durare per circa un anno, analogamente agli anticorpi contro MERS e SARS-CoV-1.
Qual è la sieroprevalenza dell’infezione nei diversi Paesi?
I risultati dei primi studi sieroepidemiologici, riconoscendo i limiti sopra descritti, indicano che finora poche persone hanno evidenza di infezione. Ciò suggerisce che ci sono molte persone ancora suscettibili all’infezione, informazione importante per definire i piani politici per un’eventuale successiva recrudescenza dell’infezione.
I primi risultati di Germania, Paesi Bassi, Regno Unito, Francia, Danimarca, Stati Uniti d’America, Svizzera, Finlandia, Giappone, Italia, Cina, Spagna, Brasile, Croazia, Andorra e Lussemburgo hanno dimostrato che per la maggior parte delle popolazioni in esame, l’entità dell’infezione è inferiore al 10%, con poche eccezioni legate a particolari hotspot epidemici (uno studio tedesco intorno al 14%, un rapporto tra i primi soccorritori nello Stato di New York al 10–17%, e due documenti da Trieste, Italia, al 17,2%, e donatori di sangue e bambini a Londra all’11,3%)18. Diversi lavori sono attualmente in fase di valutazione scientifica e verranno resi disponibili online nelle prossime settimane o mesi.
I test sierologici possono fornire un “passaporto di immunità”?
Alcuni governi hanno suggerito che il rilevamento di anticorpi contro SARS-CoV-2 potrebbe servire come base per un “passaporto di immunità” che consentirebbe alle persone di viaggiare o tornare al lavoro assumendo che siano protetti contro la reinfezione. A questo punto della pandemia, non ci sono prove sufficienti sull’efficacia dell’immunità mediata da anticorpi per garantire l’accuratezza di un passaporto dell’immunità. Cioè, attualmente non ci sono prove per determinare se le persone che si sono riprese dalla COVID-19 e hanno prodotto anticorpi specifici siano protette da una seconda infezione.
“Per i non esperti”
Risposta immunitaria umorale al SARS-CoV2
Nella risposta immunitaria umorale alle infezioni, gli anticorpi specifici contro le proteine del patogeno, prodotti dai linfociti B, neutralizzano e prevengono l’ulteriore diffusione della malattia. L’attivazione e il differenziamento dei linfociti B in plasmacellule che secernono anticorpi sono innescati da una cascata di eventi che coinvolgono la digestione del virus da parte delle cellule presentanti l’antigene (per esempio, le cellule dendritiche e i macrofagi) e la presentazione di antigeni specifici del virus ai linfociti T helper. Gli anticorpi proteggono l’ospite legandosi ad antigeni specifici (proteine) sul virus per neutralizzarne la fusione e l’ingresso nella cellula ospite e facilitare il riconoscimento e l’uccisione da parte di cellule immunitarie fagocitiche19. Nell’essere umano, tre tipi di anticorpi o immunoglobuline sono stati analizzati nei test sierologici per la COVID-19: IgM, IgG e IgA. Sebbene le dinamiche della risposta immunitaria in COVID-19 non siano ancora completamente comprese, tipicamente gli anticorpi IgM sono prodotti dalle cellule immunitarie dell’ospite durante le prime fasi di un’infezione virale. L’IgG è spesso l’anticorpo più abbondante nel sangue e svolge un ruolo più importante nelle fasi successive dell’infezione e nello stabilire la memoria immunitaria a lungo termine20. Mentre gli anticorpi IgM e IgG sono stati i principali candidati nello sviluppo del test sierologico per la COVID-19, studi recenti mostrano che le IgA, prevalentemente presente nel tessuto mucosale, per esempio dei polmoni e dell’intestino, possono svolgere un ruolo critico nella risposta immunitaria e nella progressione della malattia21,22,23.
Epitopi
Il termine epitopi è usato per indicare le porzioni delle molecole che sono riconosciute dagli anticorpi.
Cinetica della comparsa delle varie immunoglobuline
La conoscenza delle dinamiche della risposta immunitaria del virus e dell’ospite è essenziale nella formulazione di test diagnostici e per definire le strategie di trattamento dei pazienti. Gli studi sulla COVID-19 suggeriscono che la sieroconversione, quando i livelli di anticorpi diventano rilevabili nel sangue, può avvenire pochi giorni dopo che la carica virale ha raggiunto il picco24. Pertanto, i test sierologici sono generalmente meno efficaci nelle prime fasi della COVID-19. Il tempo medio per il rilevamento di IgM e IgG nei pazienti con la COVID-19 è stato riportato essere, rispettivamente, di 5 e 14 giorni25. Yu e colleghi hanno rilevato la sieroconversione di IgA il giorno 2 e di IgM/IgG il giorno 5 dopo la comparsa dei sintomi. I loro risultati hanno anche rivelato che i livelli di IgM e IgG sono significativamente più alti nei casi gravi di COVID-19 rispetto ai pazienti con malattia lieve o moderata26, suggerendo che i test sierologici richiedono un’elevata sensibilità per rilevare livelli più bassi di anticorpi nei casi lievi. Gli studi sulla persistenza degli anticorpi nel sangue suggeriscono che sono rilevabili livelli elevati di IgG per almeno 49 giorni dopo la comparsa dei sintomi, mentre i livelli di IgM diminuiscono rapidamente intorno al 35° giorno dopo l’infezione27.
Recentemente è stato dimostrato che i soggetti convalescenti in seguito a COVID-19 paucisintomatici e asintomatici manifestano un rapido declino dei titoli anticorpali28,29,30,31.
Curva ROC
La performance di un test diagnostico può essere valutata usando le misure di sensibilità e specificità. La curva delle caratteristiche operative del ricevitore (ROC) comprende tutte le possibili soglie di decisione di positività includendo nel test tutti i risultati della coorte di convalida (cioè, tutti i campioni positivi noti e negativi noti usati per convalidare il saggio). In altre parole, una curva ROC è un grafico della sensibilità rispetto a “1−specificità di un test diagnostico”. I diversi punti sulla curva corrispondono ai diversi valori (OD) usati per determinare se i risultati del test sono positivi. Dati i risultati del test, è la probabilità che per una coppia di pazienti selezionata casualmente con e senza la malattia, il paziente con la malattia abbia un risultato che indica positività.
L’AUC (area sotto la curva) è un modo efficace per riassumere l’accuratezza diagnostica complessiva del test. Si esprime con valori da 0 a 1, dove un valore 0 indica un test perfettamente impreciso e un valore 1 riflette un test perfettamente accurato. In generale, un’AUC di 0,5 indica che non è possibile suggerire alcuna discriminazione (ovvero la capacità di diagnosticare pazienti con e senza la malattia), da 0,7 a 0,8 è considerato accettabile, da 0,8 a 0,9 è considerato eccellente e più di 0,9 è considerato eccezionale.
Produzione degli antigeni virali in laboratorio
La produzione dei frammenti della glicoproteina Spike del SARS-CoV-2 corrispondenti al dominio legante il recettore (RBD, Receptor Binding Domain)e all’ectodominio solubile avviene mediante l’espressione in cellule di mammifero HEK293T e HEK293F. In molti laboratori sono stati utilizzati dei vettori pGACCS generati nel laboratorio del Prof. Krammer (Mount Sinai, Stati Uniti) e loro modifiche, il cui utilizzo per saggi diagnostici ELISA ha ricevuto l’approvazione della FDA per “uso di emergenza” il 15 Aprile 202032. I plasmidi, sintetizzati usando la sequenza genomica del virus isolato, Wuhan-Hi-1 rilasciata a Gennaio 2020, contengono codoni ottimizzati per l’espressione in cellule di mammifero. Le proteine sono espresse e secrete in forma glicosilata dalle cellule di mammifero in coltura, quindi purificate dal mezzo di coltura mediante cromatografia per affinità e quantificate. La resa stimata per la produzione del RBD in HEK293T è dell’ordine di 20 mg per litro di coltura, sufficiente per circa 180 000 saggi ELISA. Sebbene più immunogenico, le rese per l’intero dominio solubile della proteina S sono molto inferiori, pari a circa 5 mg per litro di coltura.
La produzione della nucleoproteina N ricombinante del SARS-CoV2 viene fatta in cellule batteriche BL21-pLysS mediante vettori per iperespressione pET28. In questo caso il protocollo di purificazione prevede una prima colonna cromatografica per affinità, seguita da una colonna di esclusione dimensionale. Le rese stimate sono di circa 10 mg di proteina N per litro di coltura batterica, con costi ridotti di un ordine di grandezza rispetto all’espressione in cellule di mammifero e il vantaggio di poter lavorare con tempistiche di produzione più rapide33.
Bibliografia
- Wu, F., et al., A new coronavirus associated with human respiratory disease in China. Nature, 2020.
- Long, Q.X., et al., Antibody responses to SARS-CoV-2 in patients with COVID-19. Nat Med, 2020.
- Caini, S., et al., Meta-analysis of diagnostic performance of serological tests for SARS-CoV-2 antibodies up to 25 April 2020 and public health implications. Euro Surveill, 2020.
- Kontou, P.I., et al., Antibody Tests in Detecting SARS-CoV-2 Infection: A Meta-Analysis. Diagnostics (Basel), 2020.
- Seow J, G.C., Merrick B, Acors S., Longitudinal evaluation and decline of antibody responses in SARS-COV2 infection medRxiv (preprint) 2020Bruni M, et al, Persistence of anti-SARS-CoV-2 antibodies in non-hospitalized COVID-19 convalescent health care workers medRxiv (preprint) 2020.
- Parks, J.M.; Smith, J.C. How to Discover Antiviral Drugs Quickly. N. Engl. J. Med. 2020.
- Cong, Y.; Ulasli, M.; Schepers, H.; Mauthe, M.; V’Kovski, P.; Kriegenburg, F.; Thiel, V.; de Haan, C.A.M.;Reggiori, F. Nucleocapsid Protein Recruitment to Replication-Transcription Complexes Plays a Crucial Role in Coronaviral Life Cycle. J. Virol. 2020.
- Kang, S., et al., Crystal structure of SARS-CoV-2 nucleocapsid protein RNA binding domain reveals potential unique drug targeting sites. Acta Pharm Sin B, 2020.
- U.S. Food & Drug Administration. Independent Evaluations of COVID-19 Serological Tests. (Consultato ad agosto 2020)
- COVID-19 In Vitro Diagnostic Devices and Test Methods Database, covid-19-diagnostics.jrc.ec.europa.eu. (Consultato ad agosto 2020)
- Ni, L.; Ye, F.; Cheng, M.L.; Feng, Y.; Deng, Y.Q.; Zhao, H.;Wei, P.; Ge, J.; Gou, M.; Li, X.; et al. Detection of SARS-CoV-2-Specific Humoral and Cellular Immunity in COVID-19 Convalescent Individuals. Immunity 2020.
- Jiang, S.; Hillyer, C.; Du, L. Neutralizing Antibodies against SARS-CoV-2 and Other Human Coronaviruses: Trends Immunol. 2020.
- Amanat, F., et al., A serological assay to detect SARS-CoV-2 seroconversion in humans. Nat Med, 2020.
- Seydoux, E., et al., Analysis of a SARS-CoV-2-Infected Individual Reveals Development of Potent Neutralizing Antibodies with Limited Somatic Mutation. Immunity, 2020.
- Carsetti R, Z.S., Piano Mortari E, Terreri S, Spectrum of innate and adaptive immune response to SARS-CoV-2 infection across asymptomatic, mild and severe cases-a longitudinal study. 2020.
- Long, Q.X., et al., Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nat Med, 2020.
- Stadlbauer, D., et al., SARS-CoV-2 Seroconversion in Humans: A Detailed Protocol for a Serological Assay, Antigen Production, and Test Setup. Curr Protoc Microbiol, 2020. 57(1): p. e100.
- European Centre for Disease Prevention and Control, Situation updates on COVID-19 (Consultato ad agosto 2020)
- Janeway, C.A. Immunobiology, 9th edition: The Immune System in Health and Disease; Garland Publishing: New York, NY, USA, 2016.
- Azkur, A.K.; Akdis, M.; Azkur, D.; Sokolowska, M.; van de Veen, W.; Bruggen, M.C.; O’Mahony, L.; Gao, Y.; Nadeau, K.; Akdis, C.A. Immune response to SARS-CoV-2 and mechanisms of immunopathological changes in COVID-19. Allergy 2020.
- Yu, H.Q.; Sun, B.Q.; Fang, Z.F.; Zhao, J.C.; Liu, X.Y.; Li, Y.M.; Sun, X.Z.; Liang, H.F.; Zhong, B.; Huang, Z.F.; et al. Distinct features of SARS-CoV-2-specific IgA response in COVID-19 patients. Eur. Respir. J. 2020.
- Padoan, A., et al., IgA-Ab response to spike glycoprotein of SARS-CoV-2 in patients with COVID-19: A longitudinal study. Clin Chim Acta, 2020.
- Dahlke C, H.J., Kobbe R, Distinct early IgA profile may dteremine severity of COVID-19 symptoms: an immunological case series. medRxiv (preprint) 2020.
- To, K.K.; Tsang, O.T.; Leung, W.S.; Tam, A.R.; Wu, T.C.; Lung, D.C.; Yip, C.C.; Cai, J.P.; Chan, J.M.; Chik, T.S.; et al. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: An observational cohort study. Lancet Infect. Dis. 2020.
- Guo, L.; Ren, L.; Yang, S.; Xiao, M.; Chang, D.; Yang, F.; Dela Cruz, C.S.; Wang, Y.; Wu, C.; Xiao, Y.; et al. Profiling Early Humoral Response to Diagnose Novel Coronavirus Disease (COVID-19). Clin. Infect. Dis. 2020.
- Yu, H.Q.; Sun, B.Q.; Fang, Z.F.; Zhao, J.C.; Liu, X.Y.; Li, Y.M.; Sun, X.Z.; Liang, H.F.; Zhong, B.; Huang, Z.F.; et al. Distinct features of SARS-CoV-2-specific IgA response in COVID-19 patients. Eur. Respir. J. 2020.
- Tan, W.L.Y.; Zhang, J. Viral Kinetics and Antibody Responses in Patients with COVID-19. medRxiv (preprint) 2020.
- Seow J, G.C., Merrick B, Acors S., Longitudinal evaluation and decline of antibody responses in SARS-COV2 infection. medRxiv (preprint) 2020.
- Bruni M, et al, Persistence of anti-SARS-CoV-2 antibodies in non-hospitalized COVID-19 convalescent health care workers medRxiv (preprint) 2020.
- Carsetti R, Z.S., Piano Mortari E, Terreri S, Spectrum of innate and adaptive immune response to SARS-CoV-2 infection across asymptomatic, mild and severe cases-a longitudinal study. medRxiv (preprint) 2020.
- Long, Q.X., et al., Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nat Med, 2020.
- Stadlbauer, D., et al., SARS-CoV-2 Seroconversion in Humans: A Detailed Protocol for a Serological Assay, Antigen Production, and Test Setup. Curr Protoc Microbiol, 2020. 57(1): p. e100.
- Bruni M, et al, Persistence of anti-SARS-CoV-2 antibodies in non-hospitalized COVID-19 convalescent health care workers medRxiv (preprint) 2020


 Scarica il PDF dell'articolo
Scarica il PDF dell'articolo
Commenti