di Barbara Illi
Istituto di Biologia e Patologia Molecolari, Consiglio Nazionale delle Ricerche (IBPM-CNR), c/o Dipartimento di Biologia e Biotecnologie “Charles Darwin”, Sapienza Università di Roma
Indice dei contenuti
- Introduzione
- L’iperinfiammazione: una lezione dal processo di invecchimento
- La patologia polmonare: malattia lieve versus malattia severa
- Implicazioni cardiovascolari
- Manifestazioni gastorintestinali ed epatiche
- La COVID-19 e il sistema nervoso
- I casi asintomatici
- Conclusioni
“Per i non esperti”
- Dispnea
- Emottisi
- Iposmia
- Rinorrea
- RNAemia
- Tropismo
- Potenziamento dipendente da anticorpo
- Fattori di trascrizione
- Mitocondrio
- Mitofagia
- Autofagia
- Adipochine
- Ipossiemia
- Mielite trasversa
Bibliografia
Introduzione
Il decorso clinico della COIVD-19 presenta un ampio spettro di severità. Da febbraio 2020 a oggi (agosto 2020), tra i sintomi sono stati rilevati febbre (98%), tosse (76%), dispnea (55%), mialgia o stanchezza (44%), catarro (28%), faringite (12%), mal di testa (8%), emottisi (5%), e diarrea (3%)1,2. Tuttavia, nei casi lievi, la febbre si presenta nell’11% dei pazienti, laddove i sintomi più frequenti sono faringite, tosse, accompagnati da iposmia, congestione nasale e rinorrea3.
Il decorso severo della malattia presenta spesso le caratteristiche della sindrome da distress respiratorio acuto (ARDS, Acute Respiratory Distress Syndrome), con dispnea che si presenta in genere otto giorni dopo l’insorgenza dei sintomi e con una progressione rapida verso lo shock settico e la disfunzione di molteplici organi1.
La terapia intensiva è necessaria, secondo le statistiche disponibili a oggi, dal 3 al 29% dei casi. Le complicazioni sono rappresentate da RNAemia, infarto del miocardio, infarto renale, infezioni secondarie. Le co-morbidità maggiori sono ipertensione, diabete e malattie cardiovascolari, in percentuale diversa, a seconda dello studio considerato. La TAC del torace dei pazienti moderati-severi ha mostrato alterazioni bilaterali nel 90% dei casi2. I parametri di laboratorio includono alti livelli di diverse citochine, linfopenia e eosinopenia (v. L’esercito e le armi contro il SARS-CoV-2). Nonostante questo quadro clinico, il rapido peggioramento dei pazienti con COVID-19, che può avvenire nell’arco di poche ore, ha fatto nascere l’ipotesi che la patofisiologia di questa malattia non fosse quella tipica dell’ARDS. Inoltre, l’elevato tropismo di SARS-CoV-2 (di seguito indicato come CoV-2) estende, raramente, le manifestazioni cliniche della COVID-19 ad altri organi oltre ai polmoni, incluso il sistema nervoso centrale (SNC).
L’iperinfiammazione: una lezione dal processo di invecchimento
È ampiamente accettato che la COVID-19, nella sua forma più aggressiva, sia una sindrome iperinfiammatoria, dovuta sia alla produzione eccesiva di citochine proinfiammatorie che alla disfunzione della risposta immunitaria. Infatti, nonostante lo spettro molto ampio di tessuti che il CoV-2 può infettare, la distruzione multiorgano che caratterizza i pazienti con la COVID-19 grave dipende, soprattutto, da una risposta immunitaria incontrollata, piuttosto che da danno tissutale diretto dovuto all’infezione virale. Inoltre, il cosiddetto potenziamento dipendente da anticorpo (ADE, Antibody-Dependent Enhancement), non può essere escluso come conseguenza dell’infezione da CoV-2 e come causa della COVID-194.
L’età gioca un ruolo importante nel determinare il grado di severità della malattia. Nella stragrande maggioranza dei casi, le persone giovani, compresi i bambini (v. Le eccezioni alla regola dell’infezione), sviluppano una malattia lieve/moderata. Questo sembra dipendere dal fatto che nei giovani il sistema immunitario risponde in modo corretto.
L’immunità innata, che impiega leucociti, cellule natural killer (NK), mastociti e cellule epiteliali polmonari, è la prima barriera contro l’infezione dal CoV-25. Le cellule dendritiche del polmone, localizzate nell’epitelio e negli spazi del tratto respiratorio, nei setti alveolari e capillari polmonari6, si specializzano come cellule presentanti l’antigene (APC, Antigen Presenting Cells), migrano nei linfonodi per presentare gli antigeni virali (dopo averli complessati all’interno delle molecole di superficie del complesso maggiore di istocompatibilità, o MHC, Major Histocompatibility Complex) ai linfociti T helper (Th0). Queste cellule differenziano ulteriormente in linfociti T CD4+ e CD8+. Dai linfociti CD4+ Th0 derivano i linfociti Th1, che governano l’immunità cellulare, e i linfociti Th2, che guidano l’immunità umorale7,8.
Ogni classe di linfociti Th possiede un diverso profilo di citochine; in particolare, i linfociti Th1 secernono citochine proinfiammatorie7,8 mentre i linfociti Th2 rilasciano citochine antinfiammatorie9. Questo bilanciamento sembra spegenere la risposta immunitaria in modo appropriato10 e caratterizza la reazione del sistema immunitario all’infezione da CoV-2 nei giovani.
Questa sequenza controllata di eventi è alterata in età avanzata, il che porta a non attivare efficacemente le vie di segnale antinfiammatorie. La tempesta di citochine, insieme al decremento di diverse cellule immunitarie che caratterizza i pazienti con la COVID-19 grave (v. L’esercito e le armi contro il SARS-CoV-2), è direttamente responsabile della disfunzione multiorgano, come testimoniato dalle autopsie di pazienti in età avanzata, che hanno riportato atrofia e necrosi della milza, necrosi dei linfonodi, emorragia renale, epatomegalia e degenerazione dei neuroni del SNC. Inoltre, sono state trovate delle cellule immunitarie, tipicamente macrofagi e monociti, nell’infiltrato dei polmoni di pazienti anziani deceduti11,12.
Una delle possibili spiegazioni per l’inasprimento dei sintomi in età avanzata è il livello cronicamente aumentato di infiammazione, un fenomeno detto inflam-aging (inflam, infiammazione; aging, invecchiamento; Figura 1), che porta alla produzione di citochine proinfiammatorie13, quali interleuchina 6 (IL6), IL8, fattore α di necrosi del tumore (TNFα), IL13, interferone γ (IFNγ), e di proteine della fase acuta, che giocano un ruolo fondamentale nell’insorgenza di malattie legate all’invecchiamento, come il diabete e l’Alzheimer. Diverse condizioni sono substrato e causa dell’inflame-aging.
Figura 1 Principali alterazioni durante l’invecchiamento coinvolte nella COVID-19.
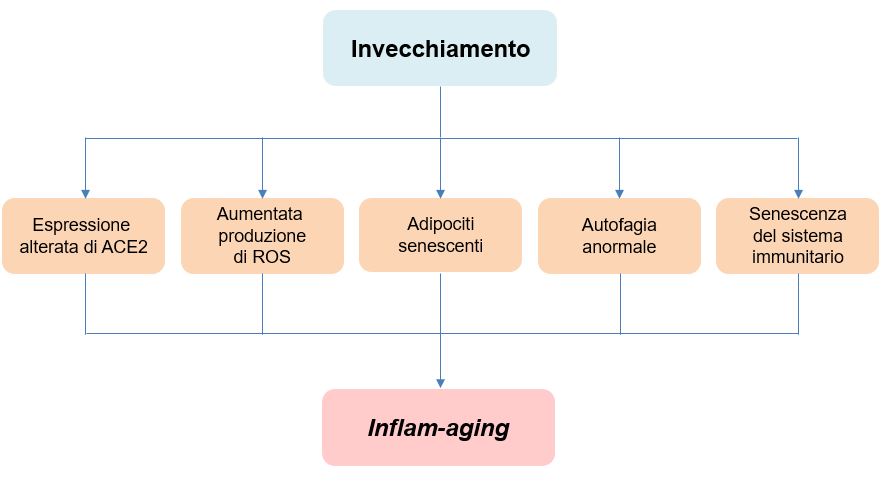
Principali alterazioni che si manifestano con l’avanzare dell’età e che portano alla cosidetta inflam-aging. [Basato su: Mefthal et al., Inflam Res, 2020]
La diminuzione nella sintesi dell’ enzima 2 che converte l’angiotensina (ACE2, Angiotensin Converting Enzyme 2) è una condizione proinfiammatoria. Infatti, nonostante l’ACE2 sia la porta d’ingresso per il CoV-2 nelle cellule bersaglio e, perciò, sarebbe concepibile che alti livelli di ACE2 corrispondessero ad alti livelli di infezione, le persone in età giovanile e pediatrica, avendo in media alti livelli di ACE2, manifestano meno i sintomi clinici della COVID-19. La via di segnalazione che coinvolge le proteine ACE2/angiotensina (1-7)/recettore Mas ha proprietà antinfiammatorie14. L’enzima ACE2 diminuisce con l’età15. Inoltre, è stata documentata una correlazione inversa tra l’espressione dell’ACE2 e la gravità della COVID-19 e i tessuti più danneggiati nei pazienti affetti sono quelli che esprimono bassi livelli di ACE216. Questo potrebbe spiegare, almeno in parte, le manifestazioni lievi nei giovani e nei bambini.
Le citochine proinfiammatorie sono rilasciate anche da altri fenomeni che avvengono tipicamente negli anziani. L’iperproduzione di specie reattive dell’ossigeno (ROS, Reactive Oxygen Species), ossia di radicali liberi, è un fenomeno tipico dell’età avanzata17. Di conseguenza, i ROS inducono la produzione di citochine proinfiammatorie, inclusi TNFα, IL1β, IL2 e IL618; queste attivano specifici fattori di trascrizione, come il fattore nucleare kB (NF-kB, Nuclear Factor-kB)19. I ROS possono essere prodotti da una disfunzione dei mitocondri dovuta all’invecchiamento20 e da una diminuizione della mitofagia, che è parte del processo di autofagia. L’ autofagia diminuisce durante l’invecchiamento21 e questo è un altro fattore chiave che contribuisce all’infiammazione cronica.
L’obesità, specialmente in età avanzata, è un altro fattore che contribuisce all’infiammazione e alla severità delle manifestazioni cliniche della COVID-19, poiché il tessuto adiposo è una delle fonti principali di citochine proinfiammatorie durante l’invecchiamento22. Infatti, è stato dimostrato che nei pazienti con la COVID-19 il tessuto adipose interagisce con il sistema immunitario, aumentando il rischio di mortalità tramite la produzione di adipochine, in particolare di amiloide A, la quale, agendo sui macrofagi, porta alla produzione di citochine proinfiammatorie23. Lo stesso sistema immunitario invecchia con l’età, con importanti cambiamenti nel fenotipo delle cellule deputate alla risposta immunitaria sia innata sia adattativa24. Questo coincide col fatto che nei pazienti con la COVID-19 grave si riscontrano linfopenia, eosinopenia, diminuzione delle cellule NK e dei monociti (v. L’esercito e le armi contro SARS-CoV-2), con una risposta immunitaria difettiva negli anziani e con uno stato cronico di lieve infiammazione del sistema immunitario. Perciò, in età avanzata è più difficile contrastare efficacemente l’iperinfiammazione dovuta alla COVID-19.
La patologia polmonare: malattia lieve versus malattia severa
Nei pazienti con la COVID-19 si osservano tipichelesioni nelle immagini radiologiche:
- immagini a “vetro smerigliato” (GGO, Ground Glass Opacity, regioni di opacità in cui le strutture e i vasi polmonari sono ancora visibili) e consolidamento (zone in cui l’aria negli alveoli è sostituita da fluidi e/o cellule) caratterizzano i pazienti con malattia lieve/moderata; meno frequentemente si osservano reticolazione, un pattern detto crazy paving, in cui l’immagine del polmone sembra quella di un pavimento formato da pietre irregolari, causata da un ispessimento dei setti interlobulari, ispessimento dei setti intralobulari e degli interstizi intralobulari, o da deposizione di materiale negli spazi occupati dall’aria ai bordi degli acini. Il picco di gravità di queste manifestazioni si ha a circa 10 giorni dall’inizio dei sintomi, per scomparire gradualmente dal 14° giorno25.
- nei pazienti con malattia severa il consolidamento è il segno maggiormente prevalente e indica la pesenza di bronchite necrotica dipendente dal virus e danno alveolare26, che porta alla produzione di essudato infiammatorio negli spazi alveolari. Inoltre, i pazienti con la COVID-19 grave mostrano frequentemente ingrossamento dei linfonodi e versamenti pericardici e pleurici27. Queste caratteristiche sono associate ad analisi del siero che mostrano leucopenia, incremento delle proteine della fase acuta e aumento di citochine proinfiammatorie.
A oggi, le tecniche radiologiche e i parametri ematologici sono ancora punti saldi di riferimento per determinare la gravità della COVID-19.
Implicazioni cardiovascolari
Oltre a essere un fattore maggiore di comorbidità, le malattie cardiovascolari possono essere una diretta conseguenza dell’infezione da Cov-2 e una complicazione importante della COVID-19. Le manifestazioni cardiovascolari vanno dalla trombosi alle tromboembolie e alla disfunzione endoteliale fino all’infarto del miocardio.
ARDS o microclots
Nella maggior parte dei pazienti la performance meccanica dei polmoni è conservata, con un’alta compliance respiratoria (cioè, il volume di gas nel polmone è ben conservato), in apparente contrasto con l’ipossiemia (bassa concentrazione di ossigeno nel sangue) severa che invece è presente. Una spiegazione potrebbe essere che, in questi pazienti, la perfusione dei polmoni sia compromessa, a causa di una trombosi del microcircolo polmonare, dipendente dall’infiammazione. Infatti, l’iperattivazione del sistema immunitario, che caratterizza i casi severi di COVID-19, può attivare localmente la cascata del complemento, che non solo danneggia direttamente l’endotelio alveolare, ma, reclutando leucociti, sostiene la risposta infiammatoria, portando alla produzione di una moltitudine di citochine (Figura 2). Anche linfociti, macrofagi, neutrofili esercitano la loro funzione proinfiammatoria, portando a un danno massiccio a livello di epitelio ed endotelio alveolare e a trombosi del microcircolo dei polmoni, come suggerito dagli elevati livelli di D-dimero e lattato deidrogenasi (Figura 3)28,29.
Figura 2 Manifestazione cliniche della COVID-19.
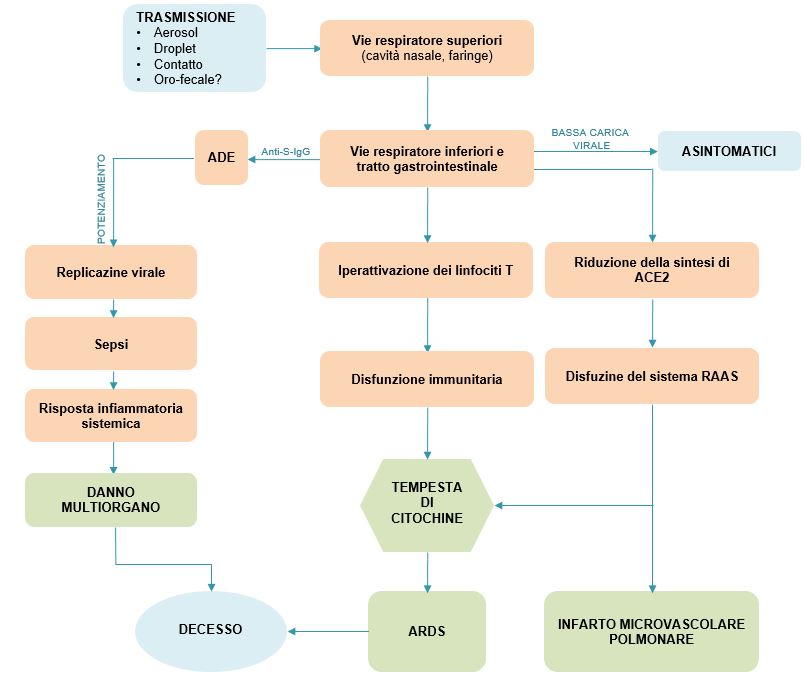
Schema che riassume le manìfestazioni cliniche della COVID-19 e la cascata di eventi che portano alla sindrome da distress respiratorio acuto (ARDS). Abbreviazioni: ARDS, Acute Respiratory Distress Syndrome (sindrome respiratoria acuta da distress).
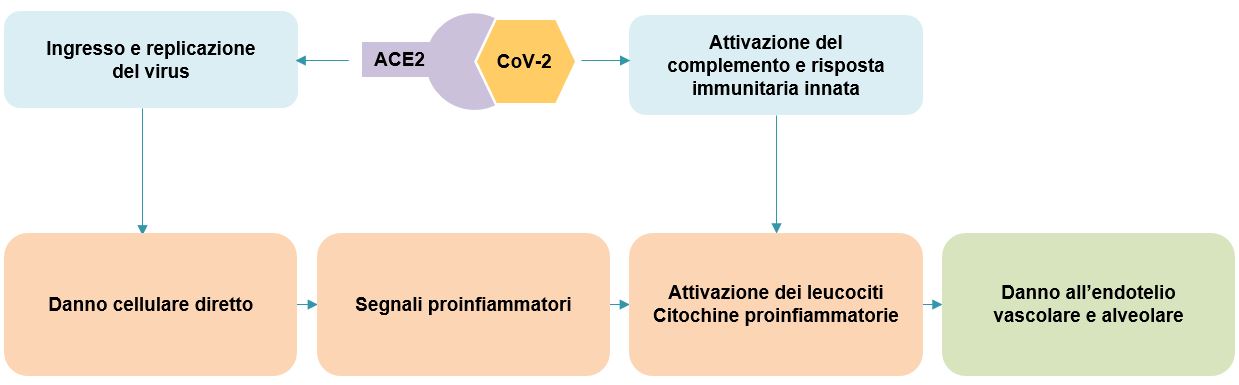
[Basato su: Ciceri et al., Am J Respir Crit Care Med. 2020]
Questa condizione locale potrebbe, potenzialmente, espandersi a livello sistemico ad altri organi vitali, come il rene e il cervello. Infatti, lì anomalie nella coagulazione, come la coagulopatia indotta da sepsi (SIC, Sepsis-Induced Coagulopathy) e la caogulazione intravasale disseminata (DIC, Disseminated Intravascular Coagulopathy), che avvengono, specificamente, in circa il 71% dei pazienti con la COVID-1930, sono tra le principali caratteristiche della forma severa di COVID-19 e sono caratterizzate da livelli aumentati di fattori procoaguulanti, come il D-dimero e il fibrinogeno. Le coagulopatie possono predisporre a trombosi venosa profonda ed embolia polmonare, entrambi manifestazione dell tromboembolia venosa31,32.Pertanto, è stato proposto di recente che il danno polmonare nei pazienti con la COVID-19 sia principalmente di origine vascolare ed è stata suggerita un’altra definizione della malattia (al posto della sindrome da distress acuto, ARDS), ossia sindrome ostruttiva tromboinfiammatoria microvascolare polmonare o microclots (Microvascular COVID-19 Lung vessels Obstructive Thromboinflammatory Syndrome)29.
ACE2 e il sistema renina-angiotensina-aldosterone (RAAS)
Il sistema renina angiotensina aldosterone (RAAS) riveste un ruolo fondamentale per la regolazione dell’omeostasi dell’organismo, poiché controlla la concentrazione di sodio plasmatico, la pressione sanguigna e il volume extracellulare. Ogni organo è influenzato dal sistema RAAS, la cui attivazione porta a ipertensione, fibrosi e infiammazione33. Gli attori di questo sistema sono la via costituita dall’enzima che converte l’angiotensina/angiotensina II/recettore di tipo 1 per l’angiotensina (ACE/AngII/AT1R, Angiotensin Converting Enzyme/Angiotensin II/Angiotensin type I receptor) che è controbilanciata da un asse non canonico costituito da ACE2/Ang 1-7/ recettore Mas.
L’enzima ACE converte l’angiotensina in AngII, che è convertita a sua volta in Ang1-7 dall’ACE2. Laddove la funzione di ACE/AngII/AT1R è di aumentare la tensione del sistema nervoso simpatico, incrementare la vasocostrizione e innalzare la pressione del sangue, inducendo infiammazione, fibrosi e ipertrofia del miocardio, la via ACE2/Ang 1-7/Mas contrasta questi effetti34. A ogni modo, nel sistema RAAS diversi componenti possono convergere per produrre lo stesso effetto fisiologico e lo stesso componente può agire su vie differenti per produrre effetti opposti. Questa flessibilità rende il sistema RAAS un modo per l’organismo di rispondere rapidamente e di adattarsi a una varietà di stimoli, mantenendo l’omeostasi. L’ACE2 esercita una funzione protettiva sugli organi poiché converte l’AngII in Ang1-7 (Figura 4). Infatti, l’AngII promuove l’infiammazione, la migrazione delle cellule endoteliali e muscolari lisce e, infine, l’aterosclerosi.
Figura 4 Rappresentazione schematica della funzione di ACE ed ACE2.
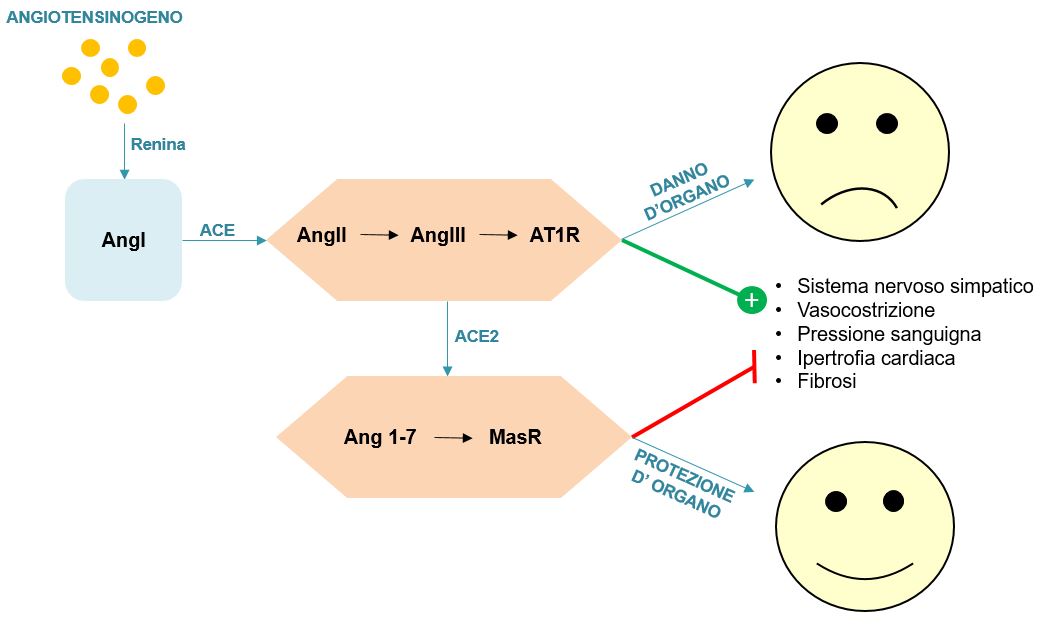
[Basato su: Cheng et al., J Med Virol, 2020]
È stato ipotizzato che la diminuita espressione di ACE2 nel corso della vita possa essere un fattore predisponente allo sviluppo della forma severa della COVID-19. Comunque, questa correlazione necessita di ulteriori valutazioni. Nei pazienti critici, il CoV-2 può impedire il funzionamento corretto e il consumo di ACE2, promuovendo uno sbilanciamento tra ACE2/AngII e determinando così l’inasprimento della patologia35.
ACE2 nel sistema cardiovascolare: al cuore di un problema clinico?
Il danno del miocardio nei pazienti con la COVID-19 (Figura 5) sembra seguire due vie distinte (Figura 2). La prima è, probabilmente, in relazione con la tempesta di citochine e presenta alti livelli della troponina cardiaca I ad alta sensibilità (hs-cTnI, high-sensitivity cardiac Troponin I), che aumenta costantemente nei pazienti che non sopravvivono e segue l’andamento delle altre citochine, dei marcatori dell’infiammazione (IL6, D-dimero, lattato deidrogenasi, ferritina) e del peptide natriuretico amminoterminale pro-tipo B (NT-proBNP, N-terminal pro B-type natriuretic peptide). Tuttavia, alcuni pazienti presentano prevalentemente manifestazioni cardiache, con shock cardiogenico severo, suggerendo l’insorgenza di miocardite virale o cardiomiopatia da stress. Questa condizione predispone ad aritmia cardiaca, che comprende fibrillazione atrio-ventricolare e tachicardia ventricolare e che è la seconda complicazione più frequente nei pazienti con la COVID-19 dopo la sindrome acuta da distress respiratorio (ARDS, Acute Respiratory Distress Syndrome)36. L’insorgenza tardiva del danno al miocardio (circa 15 giorni dopo i sintomi iniziali)37 supporta l’ipotesi di un danno cardiaco mediato dalla risposta dei linfociti T, come dimostrato dall’aumento dei linfociti T CCR6+Th17 CD4+37, che mediano la miocardite38, ma il meccanismo preciso del danno al miocardio dipendente da CoV-2 è ancora poco chiaro. L’infarto è un esito comune nei pazienti con la COVID-19. Circa il 52% delle persone decedute hanno avuto un infarto, rispetto al 12% dei sopravvissuti37.
Figura 5 Danno del miocardio.
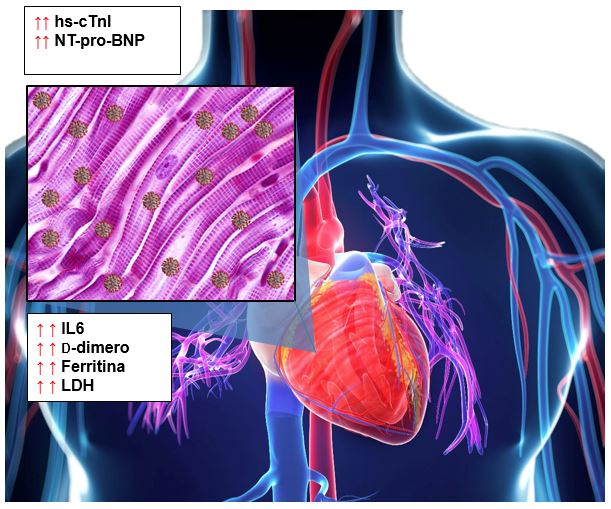
Il danno del miocardio, caratterizzato dall’incremento di hs-cTnI e NT-pro-BNP, può risultare dalla tempesta di citochine, quindi da livelli elevati di IL6, ferritina, LDH, e D-dimero o dall’effetto diretto dell’infezione del CoV-2. Abbreviazioni: hs-cTnI, troponina cardiaca I ad alta sensibilità (high sensitivity-cardiac Troponic I); NT-proBNP, peptide natriuretico amminoterminale pro-tipo B (N-Terminal pro B-type Natriuretic Peptide); IL6, interleuchina 6; LDH, lattato deidrogenasi (Lactate DeHydrogenase). [Basato su: Clerkin et al., Circulation, 2020; Fonti delle immagini: CDC (CoV2), sciepro/Shutterstock (sfondo), Jose Luis Calvo/Shutterstock (inserto)]
Il meccanismo preciso del danno del miocardio non è ancora completamente compreso. Alcuni studi suggeriscono che il danno cardiaco sia una conseguenza della tempesta di citochine e dello sbilanciamento dei linfociti Th o dell’elevata ipossia dovuta a un incremento dei livelli di calcio, che porta all’apoptosi dei cardiomiociti37,39. Inoltre, si è anche ipotizzata l’infezione diretta del cuore seguita da miocardite, ma questa eventualità non è stata confermata finora da biopsie o autopsie40. Di recente, un’elevata espressione di ACE2 è stata dimostrata nel cuore (anche più alta che nei polmoni; Figura 6A) e, specificamente, nei periciti41, molto importanti per il corretto funzionamento dei vasi sanguigni e che potrebbero essere bersagli diretti del CoV-241. Questo potrebbe impedire la corretta interazione dei periciti con l’endotelio e causare una disfunzione della microcircolazione, spiegando gli elevati livelli di creatina chinasi, indipendentemente dalla presenza o meno della tempesta di citochine. Inoltre, i pazienti con malattia cardiovascolare pregressa mostrano più alti livelli di ACE2 (Figura 6B)41. Ciò potrebbe spiegare la più alta suscettibilità all’infezione da CoV-2 dei pazienti con malattie cardiovascolari, la severità della malattia e il più elevato tasso di mortalità.
Figura 6 Espressione dell’enzima ACE2.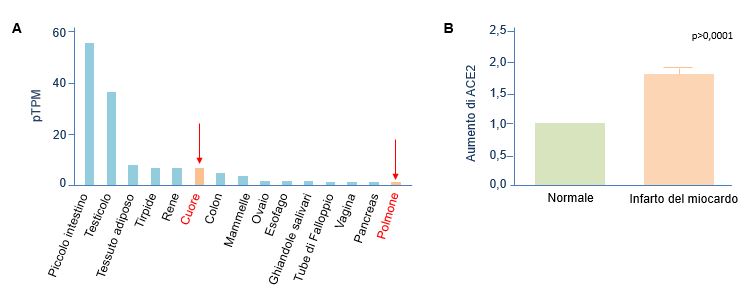
A Espressione dell’mRNA dell’ACE2 in vari tessuti. B Espressione della proteina ACE2 in cuori normale e infartuati. [Basato su: Chen et al., Cardiovascular Res, 2020]
Manifestazioni gastorintestinali ed epatiche
L’espressione di ACE2 nell’epitelio del tratto gastrointestinale e l’infezione diretta degli enterociti da parte del CoV-242 può causare disfunzione dell’ileo e del colon. Infatti, sebbene in piccola percentuale (complessivamente dal 9 al 26% in alcune popolazioni), alcuni pazienti soffrono di diarrea, nausea/vomito e dolore addominale43. Anoressia, perdita dell’olfatto e del gusto sono spesso sintomi concomitanti44. È interessante notare che, in alcuni casi, i sintomi gastrointestinali precedono quelli respiratori o si manifestano addirittura da soli45,46. Perciò, alcune persone positive al CoV-2 possono sfuggire a una diagnosi corretta quando affetti solo da sintomi gastrointestinali se i medici consultati non sono sufficientemente familiari con tali manifestazioni dovuti alla COVID-19.
I casi gravi di COVID-19 presentano alti livelli di transaminasi (ALT, alanina amino transferasi, e AST, aspartato aminotransfearsi) e di bilirubina totale43. L’ACE2 è espresso anche negli epatociti47, ma l’infezione diretta del fegato da parte della CoV-2 non è stata ancora documentata. Perciò è stata ipotizzata la tossicità epatica causata da farmaci o un danno epatico dovuto alla tempesta di citochine. Un punto da tenere in considerazione è che le persone che soffrono di malattie croniche del fegato sono a più alto rischio per la COVID-19 a causa della loro immunodeficienza48. Tuttavia, non è stata stabilita alcuna correlazione tra la malattia epatica cronica e la gravità della COVID-19 o la sua prognosi. La malattia infiammatoria dell’intestino non sembra essere una conseguenza dell’infezione da CoV-2 né un marker di predisposizione. Comunque, alcuni studi al momento suggeriscono che le persone che soffrono di infiammazione dell’intestino dovrebbero sospendere la terapia a base di immunosoppressori se affetti dalla COVID-19 fino alla guarigione49.
La COVID-19 e il sistema nervoso
Nonostante il CoV-2, come il SARS-CoV non mostri particolare neurotropismo, i neuroni e
le cellule gliali esprimono ACE250,51, perciò sono suscettibili all’infezione. Un ampio numero
di risultati sperimentali ha dimostrato che il SARS-CoV è in gradi di produrre danni al sistema nervoso.
Infatti, le particelle virali del SARS-CoV sono state individuate nel liquido cerebrospinale (LCS) di pazienti affetti da SARS52 e in reperti cerebrali autoptici53 dove i neuroni apparivano in necrosi e la glia era iperplasica. Il CoV-2 è stato individuato nell’LCS di pazienti con la COVID-1954 e questa è una chiara evidenza dell’invasione diretta del sistema nervoso da parte di questo coronavirus. Diversi studi hanno riportato sintomi neurologici in fasi precoci della malattia55,56 nonché complicazioni, come ictus ed encefalopatia acuta emorragica soprattutto in pazienti gravi che infine sono deceduti57. In alcuni casi, i tamponi nasofaringei sono risultati negativi anche se il virus era presente nell’LCS54. Sono stati riportati pochi casi di sindrome di Guillane-Barré58,59. La sindrome di Guillane-Barré, che si presenta in modo variabile con parestesia, affaticamento, polineuropatia demielinizzante, è la causa principale di paralisi60 e dipende dall’attacco del sistema immunitario al sistema nervoso periferico (SNP).
La Tabella 1 riassume le manifestazioni e le complicazioni a livello di sistema nervoso centrale e periferico della COVID-19.
Tabella 1
| SITO | MANIFESTAZIONI E COMPLICAZIONI |
| Sistema nervoso centrale |
|
| Sistena nervoso periferico |
|
Il meccanismo attraverso cui il CoV-2 può causare sintomi neuropatologici vanno dal danno ipossico, a causa del distress respiratorio, vasodilatazione periferica con ipercarbia (aumento del diossido di carbonio nel sangue), attivazione del metabolismo anaerobico e produzione di composti tossici, al danno mediato dal sistema immunitario a causa della neuroinfiammazione, guidata dalla tempesta di citochine, fino al danno cerebrale diretto. Quest’ultimo potrebbe essere la conseguenza del trasporto ematico del virus alla barriera ematoencefalica, a cui seguirebbe l’infezione diretta delle cellule endoteliali61, oppure all’arrivo nel SNC dal sistema nervoso periferico tramite i nervi craniali e gli assoni olfattivi che si proiettano nel cervello. Infatti, i nervi olfattivi sono usati come via di infezione del SNC per molti virus respiratori62.
I casi asintomatici
La trasmissione da individui asintomatici è forse il più grande problema della diffusione e del controllo della COVID-19. In assenza di screening di massa, la maggior parte delle persone asintomatiche sfugge ai test molecolari e sierologici, se non identificate a causa del tracciamento dei contatti di pazienti con la COVID-19 sintomatici.
L’esempio migliore di questo assunto è lo studio eseguito a livello di popolazione a Vò Euganeo, una piccola cittadina in provincia di Padova. Questo studio, in cui è stato testato, in due tempi diversi, l’85,9% e il 71,5% della popolazione tramite tampone nasofaringeo, ha rilevato la presenza di un 42% di asintomatici infetti63, con nessuna differenza evidente nella carica virale rispetto agli individui sintomatici.
Le caratteristiche cliniche dell’infezione asintomatica sono, in alcuni casi, lieve opacità a “vetro smerigliato”, coinvolgimento polmonare monolaterale, linfopenia e trombocitopenia64. Le caratteristiche sierologiche degli asintomatici mostrano che il livello totale delle immunoglobuline G (IgG) non è differente da quello dei pazienti sintomatici (81,1% vs 83,8%), ma i livelli di IgM sono più bassi (62,2% vs 73,8%). Inoltre, i livelli di IgG delle persone sintomatiche nella fase acuta della malattia sono consistentemente più alti che negli asintomatici, ma diminuiscono nella stessa percentuale in entrambe le categorie. Comunque, la diminuzione degli anticorpi neutralizzanti è più evidente negli asintomatici rispetto ai sintomatici. In maniera significativa, il 40% degli individui asintomatici diventa sieronegativo nella fase precoce della convalescenza rispetto al 12,9% dei pazienti sintomatici. In questi individui i livelli delle citochine proinfiammatorie, inclusa l’IL6, è più basso. Perciò, l’infezione asintomatica innesca una risposta immunitaria debole che può rendere conto, da una parte, dell’assenza di manifestazioni cliniche, ma anche del rilascio prolungato di particelle virali che può perdurare, in alcuni casi, fino a 45 giorni. Tuttavia, bisogna sottolineare che il rilascio di particelle virali non corrisponde sempre a virus vitale64.
Conclusioni
L’ampio spettro delle manifestazioni cliniche della COVID-19, la dipendenza dall’età, sesso ed etnia e il coinvolgimento multiorgano rendono questa patologia un vero enigma per ricercatori e clinici. È necessario approntare protocolli terapeutici personalizzati per pazienti con COVID-19 moderata e grave/critica (v. La lunga strada verso le terapie), mentre gli asintomatici costituiscono una via di infezione silenziosa e preoccupante. La rapida diminuzione degli anticorpi (sia IgG totali sia anticorpi neutralizzanti) nei pazienti sintomatici e in quelli asintomatici fa sorgere domande riguardo l’immunità acquisita contro il CoV-2 e la necessità di attuare in modo adeguato misure di contenimento e di eseguire studi sierologici di popolazione per determinare il reale tasso di infezione.
“Per i non esperti”
Dispnea
La dispnea indica la difficoltà a respirare.
Iposmia
L’iposmia è l’incapacità totale o parziale di sentire gli odori.
Emottisi
L’emottisi indica l’emissione di sangue con la tosse.
Rinorrea
Rinorrea è il termine medico con cui è indicato quello che comunemente è chiamato “naso che cola”.
RNAemia
Nel contesto in uso, l’RNAemia indica la presenza di RNA virale nel sangue.
Tropismo
Nel caso dei patogeni, indica la loro tendenza a colonnizzare organi, tessuto o cellule specifiche.
Potenziamento dipendente da anticorpo
Il potenziamento dipendente da anticorpo (ADE, Antibody Dependent Enhancement) è il peggioramento delle condizioni cliniche dovuto a un patogeno che induce una risposta immunitaria anticorpale.
Fattori di trascrizione
I fattori di trascrizione sono proteine che legano il DNA e sono capaci di iniziare o fermare, in tempi specifici e in risposta a determinati segnali, la produzione di RNA messaggeri che codificano l’informazione genetica. L’NF-kB è un fattore di trascrizione attivato durante l’infiammazione che lega e attiva la produzione di geni che codificano per diverse molecole proinfiammatorie, quali IL1, IL6, IL8, IFNγ, sintasi inducibile dell’ossido nitrico (iNOS, inducible Nitric Oxide Synthase), cicloosigenasi 2 (COX2).
Mitocondrio
Il mitocondrio è l’organulo in cui avviene la respirazione cellulare; questo processo permette di trasferire parte dell’energia chimica presente nell’ossigeno molecolare nei legami della molecola di adenosina trifosfato (ATP). L’energia così immagazzinata può essere usata per svolgere diversi processi biologici nei tessuti dell’organismo.
Mitofagia
La mitofagia è un processo interno alla cellula che porta all’autodistruzione dei mitocondri.
Autofagia
L’autofagia è un processo che porta alla digestione di macromolecole e componenti cellulari danneggiate all’interno di organuli detti lisosomi.
Adipochine
Le adipochine sono citochine prodotte dal tessuto adiposo e hanno come bersaglio cervello, fegato, pancreas, sistema immunitario, muscolo e altri tessuti.
Ipossiemia
L’ipossiemia è la bassa concentrazione di ossigeno nel sangue.
Mielite trasversa
La mielite trasversa è una patologia caratterizzata da demielinizzante del midollo spinale dovuta a un’attività anomala del sistema immunitario.
Bibliografia
- Tu, Y. F. et al. A Review of SARS-CoV-2 and the Ongoing Clinical Trials. Int J Mol Sci 21, doi:10.3390/ijms21072657 (2020).
- Lovato, A. & de Filippis, C. Clinical Presentation of COVID-19: A Systematic Review Focusing on Upper Airway Symptoms. Ear Nose Throat J, 145561320920762, doi:10.1177/0145561320920762 (2020).
- Kim, G. U. et al. Clinical characteristics of asymptomatic and symptomatic patients with mild COVID-19. Clin Microbiol Infect, doi:10.1016/j.cmi.2020.04.040 (2020).
- Arvin, A. M. et al. A perspective on potential antibody-dependent enhancement of SARS-CoV-2. Nature, doi:10.1038/s41586-020-2538-8 (2020).
- Robb, C. T., Regan, K. H., Dorward, D. A. & Rossi, A. G. Key mechanisms governing resolution of lung inflammation. Semin Immunopathol 38, 425-448, doi:10.1007/s00281-016-0560-6 (2016).
- Moldoveanu, B. et al. Inflammatory mechanisms in the lung. J Inflamm Res 2, 1-11 (2009).
- Kambayashi, T. & Laufer, T. M. Atypical MHC class II-expressing antigen-presenting cells: can anything replace a dendritic cell? Nat Rev Immunol 14, 719-730, doi:10.1038/nri3754 (2014).
- Luckheeram, R. V., Zhou, R., Verma, A. D. & Xia, B. CD4(+)T cells: differentiation and functions. Clin Dev Immunol 2012, 925135, doi:10.1155/2012/925135 (2012).
- Tay, M. Z., Poh, C. M., Renia, L., MacAry, P. A. & Ng, L. F. P. The trinity of COVID-19: immunity, inflammation and intervention. Nat Rev Immunol 20, 363-374, doi:10.1038/s41577-020-0311-8 (2020).
- Grodeland, G., Fossum, E. & Bogen, B. Polarizing T and B Cell Responses by APC-Targeted Subunit Vaccines. Front Immunol 6, 367, doi:10.3389/fimmu.2015.00367 (2015).
- Yao, X. H. et al. [A pathological report of three COVID-19 cases by minimal invasive autopsies]. Zhonghua Bing Li Xue Za Zhi 49, 411-417, doi:10.3760/cma.j.cn112151-20200312-00193 (2020).
- Qin, C. et al. Dysregulation of Immune Response in Patients With Coronavirus 2019 (COVID-19) in Wuhan, China. Clin Infect Dis 71, 762-768, doi:10.1093/cid/ciaa248 (2020).
- Koelman, L., Pivovarova-Ramich, O., Pfeiffer, A. F. H., Grune, T. & Aleksandrova, K. Cytokines for evaluation of chronic inflammatory status in ageing research: reliability and phenotypic characterisation. Immun Ageing 16, 11, doi:10.1186/s12979-019-0151-1 (2019).
- Rodrigues Prestes, T. R., Rocha, N. P., Miranda, A. S., Teixeira, A. L. & Simoes, E. S. A. C. The Anti-Inflammatory Potential of ACE2/Angiotensin-(1-7)/Mas Receptor Axis: Evidence from Basic and Clinical Research. Curr Drug Targets 18, 1301-1313, doi:10.2174/1389450117666160727142401 (2017).
- Xie, X., Chen, J., Wang, X., Zhang, F. & Liu, Y. Age- and gender-related difference of ACE2 expression in rat lung. Life Sci 78, 2166-2171, doi:10.1016/j.lfs.2005.09.038 (2006).
- Chen, J. et al. Individual variation of the SARS-CoV-2 receptor ACE2 gene expression and regulation. Aging Cell 19, doi:10.1111/acel.13168 (2020).
- Kauppila, T. E. S., Kauppila, J. H. K. & Larsson, N. G. Mammalian Mitochondria and Aging: An Update. Cell Metab 25, 57-71, doi:10.1016/j.cmet.2016.09.017 (2017).
- Garrido, A., Cruces, J., Ceprian, N., Vara, E. & de la Fuente, M. Oxidative-Inflammatory Stress in Immune Cells from Adult Mice with Premature Aging. Int J Mol Sci 20, doi:10.3390/ijms20030769 (2019).
- Sarkar, D. & Fisher, P. B. Molecular mechanisms of aging-associated inflammation. Cancer Lett 236, 13-23, doi:10.1016/j.canlet.2005.04.009 (2006).
- Chen, G., Kroemer, G. & Kepp, O. Mitophagy: An Emerging Role in Aging and Age-Associated Diseases. Front Cell Dev Biol 8, 200, doi:10.3389/fcell.2020.00200 (2020).
- Salminen, A., Kaarniranta, K. & Kauppinen, A. Inflammaging: disturbed interplay between autophagy and inflammasomes. Aging (Albany NY) 4, 166-175, doi:10.18632/aging.100444 (2012).
- Alicka, M. et al. Age-dependent impairment of adipose-derived stem cells isolated from horses. Stem Cell Res Ther 11, 4, doi:10.1186/s13287-019-1512-6 (2020).
- Petrakis, D. et al. Obesity a risk factor for increased COVID19 prevalence, severity and lethality (Review). Mol Med Rep 22, 9-19, doi:10.3892/mmr.2020.11127 (2020).
- Ponnappan, S. & Ponnappan, U. Aging and immune function: molecular mechanisms to interventions. Antioxid Redox Signal 14, 1551-1585, doi:10.1089/ars.2010.3228 (2011).
- Pan, F. et al. Time Course of Lung Changes at Chest CT during Recovery from Coronavirus Disease 2019 (COVID-19). Radiology 295, 715-721, doi:10.1148/radiol.2020200370 (2020).
- Koo, H. J. et al. Radiographic and CT Features of Viral Pneumonia. Radiographics 38, 719-739, doi:10.1148/rg.2018170048 (2018).
- Li, K. et al. The Clinical and Chest CT Features Associated With Severe and Critical COVID-19 Pneumonia. Invest Radiol 55, 327-331, doi:10.1097/RLI.0000000000000672 (2020).
- Gattinoni, L. et al. COVID-19 Does Not Lead to a “Typical” Acute Respiratory Distress Syndrome. Am J Respir Crit Care Med 201, 1299-1300, doi:10.1164/rccm.202003-0817LE (2020).
- Ciceri, F. et al. Microvascular COVID-19 lung vessels obstructive thromboinflammatory syndrome (MicroCLOTS): an atypical acute respiratory distress syndrome working hypothesis. Crit Care Resusc (2020).
- Tang, N., Li, D., Wang, X. & Sun, Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost 18, 844-847, doi:10.1111/jth.14768 (2020).
- Klok, F. A. et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res 191, 145-147, doi:10.1016/j.thromres.2020.04.013 (2020).
- Demelo-Rodriguez, P. et al. Incidence of asymptomatic deep vein thrombosis in patients with COVID-19 pneumonia and elevated D-dimer levels. Thromb Res 192, 23-26, doi:10.1016/j.thromres.2020.05.018 (2020).
- Patel, S., Rauf, A., Khan, H. & Abu-Izneid, T. Renin-angiotensin-aldosterone (RAAS): The ubiquitous system for homeostasis and pathologies. Biomed Pharmacother 94, 317-325, doi:10.1016/j.biopha.2017.07.091 (2017).
- Paz Ocaranza, M. et al. Counter-regulatory renin-angiotensin system in cardiovascular disease. Nat Rev Cardiol 17, 116-129, doi:10.1038/s41569-019-0244-8 (2020).
- Cheng, H., Wang, Y. & Wang, G. Q. Organ-protective effect of angiotensin-converting enzyme 2 and its effect on the prognosis of COVID-19. J Med Virol 92, 726-730, doi:10.1002/jmv.25785 (2020).
- Wang, D. et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA, doi:10.1001/jama.2020.1585 (2020).
- Zhou, F. et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 395, 1054-1062, doi:10.1016/S0140-6736(20)30566-3 (2020).
- Myers, J. M. et al. Cardiac myosin-Th17 responses promote heart failure in human myocarditis. JCI Insight 1, doi:10.1172/jci.insight.85851 (2016).
- Zheng, Y. Y., Ma, Y. T., Zhang, J. Y. & Xie, X. COVID-19 and the cardiovascular system. Nat Rev Cardiol 17, 259-260, doi:10.1038/s41569-020-0360-5 (2020).
- Gross, S., Jahn, C., Cushman, S., Bar, C. & Thum, T. SARS-CoV-2 receptor ACE2-dependent implications on the cardiovascular system: From basic science to clinical implications. J Mol Cell Cardiol 144, 47-53, doi:10.1016/j.yjmcc.2020.04.031 (2020).
- Chen, L., Li, X., Chen, M., Feng, Y. & Xiong, C. The ACE2 expression in human heart indicates new potential mechanism of heart injury among patients infected with SARS-CoV-2. Cardiovasc Res 116, 1097-1100, doi:10.1093/cvr/cvaa078 (2020).
- Lamers, M. M. et al. SARS-CoV-2 productively infects human gut enterocytes. Science 369, 50-54, doi:10.1126/science.abc1669 (2020).
- Grasselli, G. et al. Baseline Characteristics and Outcomes of 1591 Patients Infected With SARS-CoV-2 Admitted to ICUs of the Lombardy Region, Italy. JAMA, doi:10.1001/jama.2020.5394 (2020).
- Giacomelli, A. et al. Self-reported Olfactory and Taste Disorders in Patients With Severe Acute Respiratory Coronavirus 2 Infection: A Cross-sectional Study. Clin Infect Dis 71, 889-890, doi:10.1093/cid/ciaa330 (2020).
- Carvalho, A. et al. SARS-CoV-2 Gastrointestinal Infection Causing Hemorrhagic Colitis: Implications for Detection and Transmission of COVID-19 Disease. Am J Gastroenterol 115, 942-946, doi:10.14309/ajg.0000000000000667 (2020).
- Han, C. et al. Digestive Symptoms in COVID-19 Patients With Mild Disease Severity: Clinical Presentation, Stool Viral RNA Testing, and Outcomes. Am J Gastroenterol 115, 916-923, doi:10.14309/ajg.0000000000000664 (2020).
- Cao, X., Yang, F. Y., Xin, Z., Xie, R. R. & Yang, J. K. The ACE2/Ang-(1-7)/Mas axis can inhibit hepatic insulin resistance. Mol Cell Endocrinol 393, 30-38, doi:10.1016/j.mce.2014.05.024 (2014).
- Mao, R. et al. Implications of COVID-19 for patients with pre-existing digestive diseases. Lancet Gastroenterol Hepatol 5, 425-427, doi:10.1016/S2468-1253(20)30076-5 (2020).
- Cha, M. H., Regueiro, M. & Sandhu, D. S. Gastrointestinal and hepatic manifestations of COVID-19: A comprehensive review. World J Gastroenterol 26, 2323-2332, doi:10.3748/wjg.v26.i19.2323 (2020).
- Xiao, L., Haack, K. K. & Zucker, I. H. Angiotensin II regulates ACE and ACE2 in neurons through p38 mitogen-activated protein kinase and extracellular signal-regulated kinase 1/2 signaling. Am J Physiol Cell Physiol 304, C1073-1079, doi:10.1152/ajpcell.00364.2012 (2013).
- Cui, C. et al. Vitamin D receptor activation regulates microglia polarization and oxidative stress in spontaneously hypertensive rats and angiotensin II-exposed microglial cells: Role of renin-angiotensin system. Redox Biol 26, 101295, doi:10.1016/j.redox.2019.101295 (2019).
- Lau, K. K. et al. Possible central nervous system infection by SARS coronavirus. Emerg Infect Dis 10, 342-344, doi:10.3201/eid1002.030638 (2004).
- Xu, J. et al. Detection of severe acute respiratory syndrome coronavirus in the brain: potential role of the chemokine mig in pathogenesis. Clin Infect Dis 41, 1089-1096, doi:10.1086/444461 (2005).
- Moriguchi, T. et al. A first case of meningitis/encephalitis associated with SARS-Coronavirus-2. Int J Infect Dis 94, 55-58, doi:10.1016/j.ijid.2020.03.062 (2020).
- Mao, L. et al. Neurologic Manifestations of Hospitalized Patients With Coronavirus Disease 2019 in Wuhan, China. JAMA Neurol, doi:10.1001/jamaneurol.2020.1127 (2020).
- Chen, N. et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 395, 507-513, doi:10.1016/S0140-6736(20)30211-7 (2020).
- Li, Y. et al. Acute cerebrovascular disease following COVID-19: a single center, retrospective, observational study. Stroke Vasc Neurol, doi:10.1136/svn-2020-000431 (2020).
- Zhao, H., Shen, D., Zhou, H., Liu, J. & Chen, S. Guillain-Barre syndrome associated with SARS-CoV-2 infection: causality or coincidence? Lancet Neurol 19, 383-384, doi:10.1016/S1474-4422(20)30109-5 (2020).
- Toscano, G. et al. Guillain-Barre Syndrome Associated with SARS-CoV-2. N Engl J Med 382, 2574-2576, doi:10.1056/NEJMc2009191 (2020).
- Malek, E. & Salameh, J. Guillain-Barre Syndrome. Semin Neurol 39, 589-595, doi:10.1055/s-0039-1693005 (2019).
- Buzhdygan, T. P. et al. The SARS-CoV-2 spike protein alters barrier function in 2D static and 3D microfluidic in vitro models of the human blood-brain barrier. bioRxiv, doi:10.1101/2020.06.15.150912 (2020).
- van Riel, D., Verdijk, R. & Kuiken, T. The olfactory nerve: a shortcut for influenza and other viral diseases into the central nervous system. J Pathol 235, 277-287, doi:10.1002/path.4461 (2015).
- Lavezzo, E. et al. Suppression of a SARS-CoV-2 outbreak in the Italian municipality of Vo’. Nature, doi:10.1038/s41586-020-2488-1 (2020).
- Long, Q. X. et al. Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nat Med 26, 1200-1204, doi:10.1038/s41591-020-0965-6 (2020).


 Scarica il PDF dell'articolo
Scarica il PDF dell'articolo
Commenti